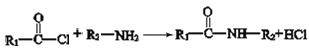题目内容
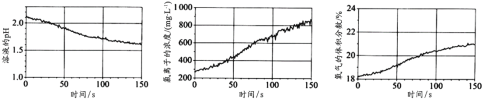
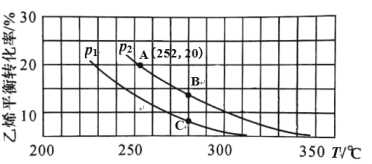
【题目】用CO2和H2合成甲醇的化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) H,按相同的物质的量投料,测得CO2在不同温度下(T1< T2)的平衡转化率与压强的关系如下图所示。下列说法正确的是
CH3OH(g)+H2O(g) H,按相同的物质的量投料,测得CO2在不同温度下(T1< T2)的平衡转化率与压强的关系如下图所示。下列说法正确的是
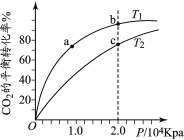
A.该反应的ΔH>0B.正反应速率:υ(a)>υ(c)
C.CH3OH的体积分数:φ(b)<φ(a)D.平衡常数:K(b)>K(c)
【答案】D
【解析】
A. 根据CO2的平衡含量与温度的关系,结合平衡移动原理分析;
B. 利用温度、压强对化学反应速率的影响分析;
C. 在温度不变时,利用压强对平衡移动的影响分析判断;
D. 化学平衡常数只与温度有关,根据温度对平衡移动的影响分析。
A. 由于温度:T1<T2,根据图象可知:升高温度,平衡时CO2(g)转化率降低,说明升高温度,化学平衡逆向移动,由于升高温度化学平衡向吸热反应方向移动,逆反应为吸热反应,则该反应的正反应为放热反应,故该反应的ΔH<0,A错误;
B. c点的温度、压强比b点大。由于升高温度反应速率加快;增大压强化学反应速率加快,所以正反应速率υ(a)<υ(c),B错误;
C. a、b两点反应温度相同,压强:b>a,在温度不变时,增大压强化学平衡向气体体积减小的正反应方向移动,反应达到平衡后,由于气体总物质的量减小,甲醇的物质的量增加,所以CH3OH的体积分数:φ(b)>φ(a),C错误;
D. 根据选项A分析可知:该反应的正反应为放热反应,ΔH<0,温度:T1<T2,升高温度,化学平衡向吸热的反应热方向移动,所以化学平衡常数K(b)>K(c),D正确;
故合理选项是D。

【题目】以含镍废硫酸盐(含 Ni2+ 、Fe2+ 、Cu2+ 、Co2+ 、A13+ 、Mn2+ 、Cr3+ 、Mg2+ 、Zn2+ 等)为原料制取NiSO4·6H2O 的工艺流程如下:
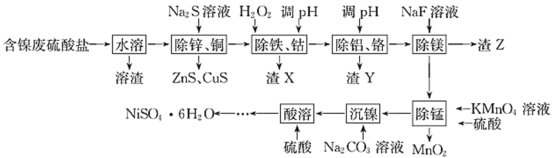
相关金属离子形成氢氧化物沉淀的pH 范围如下:
金属离子 | Co2+ | Co3+ | Fe2+ | Fe3+ | A13+ | Cr3+ | Ni2+ |
开始沉淀的pH | 7.2 | 0.23 | 6.3 | 1.5 | 4.1 | 4.3 | 6.9 |
沉淀完全的pH | 9.2 | 1.1 | 8.3 | 2.8 | 5.4 | 5.6 | 8.9 |
回答下列问题:
(1)已知1gKsp(CuS)= -47.6,1gKsp(ZnS)= -23.8,则反应ZnS+Cu2+![]() CuS+Zn2+的平衡常数对数值1gK= ________________________。
CuS+Zn2+的平衡常数对数值1gK= ________________________。
(2)“除铁、钴”时,加入H2O2的目的是 ______________,得到的渣X为________。
(3) “除铝、铬”时,调pH 范围为 _________;滤渣Y 中含Cr(OH)3,其性质与 A1(OH)3 类似,写出Cr(OH)3与NaOH反应的化学方程式: __________________。
(4)“除锰”时,发生反应的离子方程式为___________________________。
(5)“酸溶”得到溶液制备 NiSO4·6H2O晶体,还需进行的操作工艺是___________。