题目内容
【题目】有关物质的量的计算是中学化学的重要部分,请回答下列有关物质的量的计算问题。
(1)等质量的O2和O3所含分子个数比为________,所含原子个数比为_______。
(2)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是__________(用含NA的式子表示)。
(3)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为__________。
(4)标准状况下,将V L A气体(摩尔质量为M g/mol)完全溶于0.1 L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为_______mol/L。
(5)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后(溶液体积保持不变),溶液中SO42-的物质的量浓度为____________。
【答案】3:2 1:1 ![]() 48.3%
48.3% ![]() mol/L 0.4mol/L
mol/L 0.4mol/L
【解析】
(1)根据![]() 可知,等质量的O2和O3所含分子个数之比与摩尔质量成反比;
可知,等质量的O2和O3所含分子个数之比与摩尔质量成反比;
(2)气体的组分都为氧气,所以其质量与分子数成正比,据此计算cg氧气中的分子数,再计算其物质的量,进而计算体积;
(3)首先根据同温同压下,气体物质有以下关系![]() ,计算混合气体的平均相对分子质量,其中CO、N2的相对分子质量都是28,因此可看作CO和O2的混合气体;
,计算混合气体的平均相对分子质量,其中CO、N2的相对分子质量都是28,因此可看作CO和O2的混合气体;
(4)根据公式![]() ,
,![]() 进行计算;
进行计算;
(5)混合前后SO42-的物质的量不变。
(1)根据![]() 可知,等质量的O2和O3所含分子个数之比与摩尔质量成反比,所以二者分子数之比=48g/mol:32g/mol=3:2,根据分子构成知,其原子个数之比=(3×2):(2×3)=1:1,故答案为:3:2;1:1;
可知,等质量的O2和O3所含分子个数之比与摩尔质量成反比,所以二者分子数之比=48g/mol:32g/mol=3:2,根据分子构成知,其原子个数之比=(3×2):(2×3)=1:1,故答案为:3:2;1:1;
(2)ag氧气含有的分子数为b,设c g氧气含有的分子数为x,气体的组分都为氧气,所以其质量与分子数成正比,则有![]() ,解得
,解得![]() ,cg氧气的物质的量为
,cg氧气的物质的量为![]() ,则其体积为
,则其体积为![]() ,故答案为:
,故答案为:![]() ;
;
(3)混合气体的密度是H2的14.5倍,同温同压下,气体物质有以下关系![]() ,则混合气体的平均相对分子质量为14.5×2=29,CO、N2的相对分子质量都是28,因此可看作是CO和O2的混合气体,设CO和N2的总物质的量为xmol,O2的物质的量为ymol,则28x+32y=29(x+y),整理得
,则混合气体的平均相对分子质量为14.5×2=29,CO、N2的相对分子质量都是28,因此可看作是CO和O2的混合气体,设CO和N2的总物质的量为xmol,O2的物质的量为ymol,则28x+32y=29(x+y),整理得![]() ,若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为
,若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为![]() ,故答案为:48.3%;
,故答案为:48.3%;
(4)该气体的物质的量为![]() ,质量为
,质量为![]() ,溶液的体积为
,溶液的体积为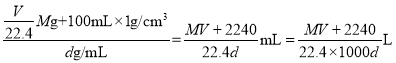 ,则此溶液的物质的量浓度为
,则此溶液的物质的量浓度为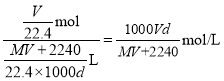 ,故答案为:
,故答案为:![]() mol/L;
mol/L;
(5)混合前后SO42-的物质的量不变,n(SO42-)=0.1L×0.3mol/L+0.05L×0.2mol/L×3=0.06mol,溶液的体积为150mL,则混合后溶液中SO42-的物质的量浓度为![]() ,故答案为:0.4mol/L。
,故答案为:0.4mol/L。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案