题目内容
【题目】氢气、碳氧化物是合成可再生能源甲醇的基础原料,具有重要的应用前景。
(1)已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ/mol、283.0 kJ/mol和890.0 kJ/mol。一定条件下,CO与H2合成燃烧的热化学方程式为:CO(g)+3H2(g)=CH4(g)+H2O(l) △H,则△H=___;该反应能自发进行的原因是___。
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
反应B:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
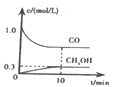
①一定温度下,在体积可变的恒压密闭容器中加入4 mol H2和一定量的CO发生反应A,开始时容器体积为2 L,CO和CH3OH(g)的浓度随时间变化如图1所示,10 min时达到平衡,则反应A的化学平衡常数为_______。(结果保留一位小数)。
②恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,下列描述能说明反应B已经达到平衡状态的是___(填序号)。
A. 容器内CO2的体积分数不再变化
B. 当CO2和H2转化率的比值不再变化
C. 当水分子中断裂2NA个O-H键,同时氢分子中断裂3NA个H-H健
D. 容器内混合气体的平均相对分子质量达到34.5,且保持不变
【答案】-250.4 kJ/mol 该反应的焓变数值较大,且小于0 0.1 (L/mol)2 ABCD
【解析】
(1)写出三种物质燃烧的热化学方程式,然后根据盖斯定律计算所求反应的焓变,当△G=△H-T△S<0时,反应能自发进行;
(2)①根据图象分析,反应开始时CO浓度为1 mol/L,由于开始时容器体积为2 L,则开始时CO的物质的量是2 mol,反应达到平衡状态时c(CH3OH)=0.3 mol/L,起始时在体积可变的恒压密闭容器中加入4 mol H2和2 mol CO发生反应A:CO(g)+2H2(g)![]() CH3OH(g),根据物质反应转化关系得到平衡时各种气体的物质的量,然后假设此时容器容积为V L,利用浓度定义式和甲醇浓度,可得转化物质的量与容器体积关系式,再根据恒温恒压下气体的物质的量的比等于压强之比,计算出转化的物质的量及平衡时容器容积,进而得到平衡时各种物质的浓度,带入平衡常数表达式即可求解;
CH3OH(g),根据物质反应转化关系得到平衡时各种气体的物质的量,然后假设此时容器容积为V L,利用浓度定义式和甲醇浓度,可得转化物质的量与容器体积关系式,再根据恒温恒压下气体的物质的量的比等于压强之比,计算出转化的物质的量及平衡时容器容积,进而得到平衡时各种物质的浓度,带入平衡常数表达式即可求解;
②恒温恒容条件下,在密闭容器中通入等物质的量的CO2 和H2,发生反应B:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),达到平衡状态时,v正=v逆,容器内混合气体的平均相对分子质量等于以g/mol为单位的平均摩尔质量,据此分析。
CH3OH(g)+H2O(g),达到平衡状态时,v正=v逆,容器内混合气体的平均相对分子质量等于以g/mol为单位的平均摩尔质量,据此分析。
(1) H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ/mol、283.0 kJ/mol和890.0 kJ/mol。
①H2(g)+![]() O2(g)= H2O(l)△H1=-285.8 kJ/mol
O2(g)= H2O(l)△H1=-285.8 kJ/mol
②CO(g)+![]() O2(g)= CO2(g)△H2=-283.0 kJ/mol
O2(g)= CO2(g)△H2=-283.0 kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H3=-890.0 kJ/mol
将①×3+②-③,整理可得:CO(g)+3H2(g)=CH4(g)+H2O(l)△H =3△H1+△H2-△H3=-250.4 kJ/mol,
当△G=△H-T△S<0时,反应能自发进行,该反应中焓变数值较大且小于0,所以能自发进行;
(2)①根据图象分析,反应达到平衡状态时c(CH3OH)=0.3 mol/L,起始时在体积可变的恒压密闭容器中加入4 mol H2和一定量的CO发生反应A:CO(g)+2H2(g)![]() CH3OH(g),开始时容器体积为2 L,根据理想气体状态方程pV=nRT,则有p=cRT,由于反应为恒压容器,所以始末态体系压强相等,根据图象可知在反应开始时c(CO)=1 mol/L,则开始时n(CO)=1 mol/L×2 L=2 mol,n(H2)=4 mol,假设反应过程在反应产生CH3OH的物质的量为x,则反应消耗CO为x mol,消耗H2为2x mol,所以平衡时CO为(2-x)mol,H2为(4-2x)mol,CH3OH为x mol,假设平衡时容器的容积为V L,则
CH3OH(g),开始时容器体积为2 L,根据理想气体状态方程pV=nRT,则有p=cRT,由于反应为恒压容器,所以始末态体系压强相等,根据图象可知在反应开始时c(CO)=1 mol/L,则开始时n(CO)=1 mol/L×2 L=2 mol,n(H2)=4 mol,假设反应过程在反应产生CH3OH的物质的量为x,则反应消耗CO为x mol,消耗H2为2x mol,所以平衡时CO为(2-x)mol,H2为(4-2x)mol,CH3OH为x mol,假设平衡时容器的容积为V L,则![]() =0.3 mol/L,所以x=0.3V mol,在恒温恒压下气体的物质的量的比等于压强之比,所以
=0.3 mol/L,所以x=0.3V mol,在恒温恒压下气体的物质的量的比等于压强之比,所以![]() =
=![]() ,解得V=
,解得V=![]() L,x=0.5 mol,所以平衡时c(CO)=
L,x=0.5 mol,所以平衡时c(CO)= =0.9 mol/L,c(H2)=2c(CO)=1.8 mol/L,c(CH3OH)=0.3 mol/L,故该反应的化学平衡常数K=
=0.9 mol/L,c(H2)=2c(CO)=1.8 mol/L,c(CH3OH)=0.3 mol/L,故该反应的化学平衡常数K=![]() =
=![]() (L/mol)2≈0.1(L/mol)2;
(L/mol)2≈0.1(L/mol)2;
②A. 容器内CO2的体积分数随着反应进行而变化,当容器内CO2的体积分数不再变化时,反应达到平衡状态,A正确;
B. CO2和H2的物质的量的比不等于化学计量数之比,则CO2和H2转化率的比值随着反应进行而变化,当CO2和H2转化率的比值不再变化,反应达到平衡状态,B正确;
C. 当水分子中断裂2NA个O-H键,必然会同时产生3NA个H-H键,同时氢分子中断裂3NA个H-H键,则氢气的浓度不变,正反应速率等于逆反应速率,反应达到平衡状态,C正确;
D. 容器内混合气体的质量守恒,物质的量随着反应进行而变化,混合气体的平均相对分子质量也随之变化,当混合气体的平均相对分子质量为34.5且保持不变时,反应达到平衡状态,D正确;
故合理选项是ABCD。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案