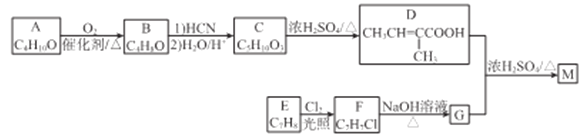
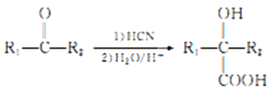题目内容
【题目】(化学--选修3 物质结构与性质)
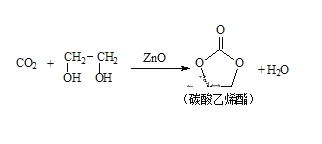
二氧化碳和乙二醇在氧化锌或锌盐催化下可合成碳酸乙烯酯。
回答下列问题:
(1)锌基态离子的价电子排布式为_______________。
(2)乙二醇中C、H、O的电负性大小关系是__________;碳酸乙烯酯中碳原子的杂化轨道类型有___________;1mol碳酸乙烯酯中含有的σ键的数目为_______NA。
(3)锌盐水溶液中Zn2+可与H2O之间形成[Zn(H2O)6]2+,[Zn(H2O)6]2+中所含化学键的类型为____。
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为______。
(5)一种锌金合金晶体的立方体晶胞中,金原子位于顶点,锌原子位于面心,若该晶体的晶胞棱长为apm(1pm=10-12m),则该合金的密度为_______g·cm-3(用NA表示阿伏加德罗常数的值,列出算式不要求结果)。
【答案】3d10 O>C>H sp2、sp3 10 配位键、共价键 HF2- ![]()
【解析】
(1)Zn处于周期表中第4周期第ⅡB族,Zn2+的价电子排布式为3d10;
(2)乙二醇中C、H、O的电负性大小关系是O>C>H,碳酸乙烯酯中碳原子形成双键,单键,单键为σ键,双键中一根为σ键,一根为π键;
(3)配离子为[Zn(H2O)6]2+,配体为H2O,[Zn(H2O)6]2+中所含化学键的类型为配位键、共价键;
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,等电子体是指原子总数相同,价电子总数也相同的微粒,一般能形成氢键的原子有N、O、F;
(5)立方体晶胞中,金原子位于顶点,锌原子位于面心,根据晶体密度ρ=![]() 计算。
计算。
(1)Zn处于周期表中第4周期第ⅡB族,Zn2+的价电子排布式为3d10,则锌基态离子的价电子排布式为3d10;故答案为:3d10;
(2)乙二醇中C、H、O的电负性大小关系是O>C>H,碳酸乙烯酯中碳原子形成双键,单键,所以C的杂化方式有sp2、sp3,单键为σ键,双键中一根为σ键,一根为π键,所以1mol 碳酸乙烯酯中含有的σ键的数目为10NA,故答案为:O>C>H;sp2、sp3;10;
(3)配离子为[Zn(H2O)6]2+,配体为H2O,配位原子为O,[Zn(H2O)6]2+中所含化学键的类型为配位键、共价键,故答案为:配位键、共价键;
阴离子X-与CO2互为等电子体且X-内含共价键和氢键,等电子体是指原子总数相同,价电子总数也相同的微粒,一般能形成氢键的原子有N,O,F,所以阴离子X-为HF2-,故答案为:HF2-;
(4)一种锌金合金晶体的立方体晶胞中,金原子位于顶点,锌原子位于面心,顶点粒子占![]() ,面心粒子占
,面心粒子占![]() ,所以晶体中含有Au的个数为8×
,所以晶体中含有Au的个数为8×![]() =1个,含有Zn的个数为6×
=1个,含有Zn的个数为6×![]() =3个,则该合金中金原子与锌原子的个数之比为1:3,不妨取1mol这样的晶胞,即有NA个这样的晶胞,1mol晶胞的质量为m=(197+65×3)g,1个晶胞的体积为V=(a×10-10)3cm3=a3×10-30cm3,晶体密度为ρ=
=3个,则该合金中金原子与锌原子的个数之比为1:3,不妨取1mol这样的晶胞,即有NA个这样的晶胞,1mol晶胞的质量为m=(197+65×3)g,1个晶胞的体积为V=(a×10-10)3cm3=a3×10-30cm3,晶体密度为ρ=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】实验室制备 1,2二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O CH2=CH2+Br2―→BrCH2CH2Br
CH2=CH2+H2O CH2=CH2+Br2―→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用少量溴和足量的乙醇 制备1,2-二溴乙烷的装置如下图所示:
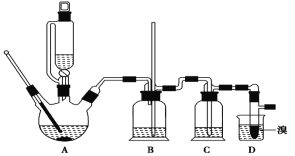
有关数据列表如下:
乙醇 | 1 ,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0 .79 | 2.2 | 0 .71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_________。(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置 C 中应加入________,其目的是吸收反应中可能生成的酸性气体。(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断 1,2-二溴乙烷制备反应已经结束的最简单方法是_________________________。
(4)将 1,2 二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在__________________层(填“上”、“下”)。
(5)若产物中有少量未反应的 Br2,最好用___________洗涤除去。(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用_____的方法除去。