题目内容
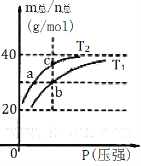
【题目】下列物质属于电解质且水溶液导电能力最强的是
A. HClO B. CO2 C. NH4Cl D. 乙醇
【答案】C
【解析】
溶于水或在熔融状态下能够导电的化合物是电解质,溶液中离子的浓度越大,所带电荷数越多,导电性越强,据此判断。
A. HClO是一元弱酸,其溶液导电性较弱,HClO属于电解质;
B. CO2溶于水生成碳酸,碳酸是二元弱酸,其溶液导电性较弱,碳酸是电解质,二氧化碳是非电解质;
C. NH4Cl溶于水完全电离出铵根离子和氯离子,其溶液导电性强,NH4Cl属于电解质;
D. 乙醇不能电离出离子,是非电解质,其水溶液几乎不导电;
根据以上分析可知答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】根据题意解答
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快.由此判断,影响化学反应速率的因素有和
(2)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
时间/min | 1 | 2 | 3 | 4 | 5 |
体积/mL | 50 | 120 | 232 | 290 | 310 |
①哪一时间段反应速率最大(填“0~1min”或“1~2min”或“2~3min”或“3~4min”或“4~5min”).
②2~3min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为 .
③试分析1~3min时间段里,反应速率变大的主要原因 .