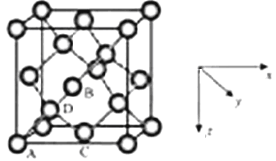
题目内容
【题目】(1)铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。
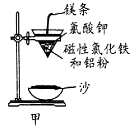
①某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 ;
②若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 ;
(2)现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,
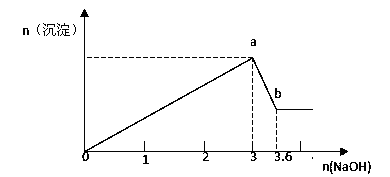
请计算出①a处沉淀的总物质的量 mol;
②c(FeCl3)= mol/L;③c(AlCl3)= mol/L
【答案】(1)①熔融的铁被空气中氧气氧化;②氢氧化钠溶液,2Al+2OH-+2H2O=2AlO![]() +3H2↑;(2)①1 ;②4;③6。
+3H2↑;(2)①1 ;②4;③6。
【解析】
试题分析:(1)①可能是熔融状态铁被空气中氧气氧化;②根据铝和铁都与酸发生反应,铝与氢氧化钠反应,产生氢气,但铁不与氢氧化钠反应,因此验证铝的可选择氢氧化钠,反应离子反应方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)①a~b段发生的反应是Al(OH)3 + OH- = AlO2- + 2H2O,根据铝元素守恒,n(AlCl3) = n[Al(OH)3] = n(NaOH) = (3.6-3)mol = 0.6mol,0~a发生反应离子反应方程式:Fe3 + + 3OH- = Fe(OH)3↓、Al3 + + 3OH- = Al(OH)3↓,Al3 + 消耗NaOH的物质的量为3×0.6mol = 1.8mol,则消耗n(Fe3 + ) = (3-1.8)/3mol = 0.4mol,n[Fe(OH)3] = 0.4mol,因此沉淀的总物质的量为(0.6 + 0.4) = 1mol;②根据①的计算,c(FeCl3) = 0.4/100×10-3mol·L-1 = 4mol·L-1;③c(AlCl3) = 0.6/100×10-3mol·L-1 = 6mol·L-1。

【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
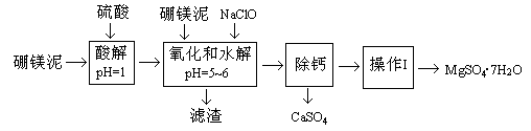
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有 。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式 。
在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法 。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 、 。