题目内容
【题目】A~J是中学化学中常见的化学物质,它们之间的相互转化关系如下列框图所示(部分反应的产物未列出)。
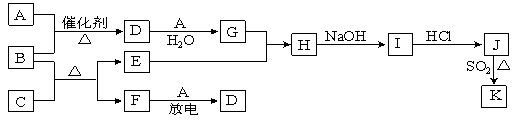
已知:A、F为无色气体单质,B为无色具有刺激性气味的碱性气体,C为黑色氧化物,E为红色金属单质。请回答下列问题:
(1)D的化学式为 ;F的电子式为 。
(2)B和C反应的化学方程式为 。该反应中生成1molF时,转移的电子数为 mol
(3)E与G的稀溶液反应的离子方程式为: 。
(4)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式 。
【答案】(1)NO,![]() ;
;
(2)3CuO+2NH3![]() 3Cu+N2+3H2O,6;
3Cu+N2+3H2O,6;
(3)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-。
【解析】
试题分析:B为无色具有刺激性气味的碱性气体,则B为NH3,E为红色金属单质,则E为Cu,C为黑色氧化物,且C能够生成Cu,则C为CuO,A为无色气体单质,且和NH3在催化氧化条件下发生反应,A为O2,D为NO,G为HNO3,F和氧气在放电条件下发生反应,且F为无色气体单质,则F为N2,Cu和硝酸反应生成后硝酸铜,即H为Cu(NO3)2,I为Cu(OH)2,J为CuCl2,(1)根据上述推断,D为NO,F为NH3,其电子式为![]() ;(2)此反应利用氨气的还原性,根据产物,推出反应方程式为:3CuO+2NH3
;(2)此反应利用氨气的还原性,根据产物,推出反应方程式为:3CuO+2NH3 ![]() 3Cu+N2+3H2O,根据反应方程式,推出生成1molN2,转移电子的物质的量为6mol;(3)铜和硝酸反应,3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O;(4)J、K是同种金属的不同的金属氯化物,且SO2还原CuCl2,即K为CuCl,2Cu2 + + 2Cl- + SO2 + 2H2O = 2CuCl↓ + 4H + + SO42- 。
3Cu+N2+3H2O,根据反应方程式,推出生成1molN2,转移电子的物质的量为6mol;(3)铜和硝酸反应,3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O;(4)J、K是同种金属的不同的金属氯化物,且SO2还原CuCl2,即K为CuCl,2Cu2 + + 2Cl- + SO2 + 2H2O = 2CuCl↓ + 4H + + SO42- 。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案