题目内容
【题目】【化学-选修3:物质结构和性质】 砷的一些化合物常用作半导体、除草剂、杀鼠药等,回答下列问题:
(1)写出基态砷原子的电子排布式_________________;有_________________个未成对电子。
(2)稼氮砷合金材料的太阳能电池效率达40%。Ga、N、As电负性由大到小的顺序是____________;
(3)As4O6的分子结构如图所示,其中As原子的杂化方式为______________,1mol As4O6含有![]() 键的物质的量为____________mol。
键的物质的量为____________mol。

(4)As与N是同族元素,AsH3的沸点比NH3的沸点 ,原因是 。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,根据结构与性质的关系,H3AsO4的酸性比H3AsO3强的原因是: 。
(6)晶胞有两个基本要素
①原子坐标参数,表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,其中原子坐标参数A处Li为(0,0,1/2);B处As为(1/4,1/4,1/4);C处Li的坐标参数为 。
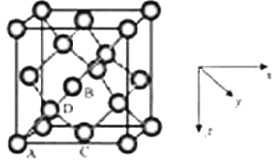
②晶胞参数,描述晶胞的大小和形状,已知LiZnAs单晶的晶胞参数,a=594pm,NA表示阿伏伽德罗常数的数值,其密度为 gcm-3(列出计算式即可)。
【答案】
(1)[Ar]3d104s24p3;3;
(2)N>As>Ga;(3)sp3;12;
(4)低;AsH3分子间不能形成氢键,而NH3分子间能形成氢键;
(5)H3AsO4和H3AsO3可分别表示为(HO)3AsO和(HO)3As,H3AsO3中的As为+3价,而H3AsO4中的As为+5价,正电性更高,导致As-O-H中O的电子向As偏移,更易电离出H+离子;
(6)①![]() ;②
;②![]() ;
;
【解析】
试题分析:(1)As的原子序数为33,由构造原理可知电子排布为1s22s22p63s23p63d104s24p3,有3个未成对电子,故答案为1s22s22p63s23p63d104s24p3;3;
(2)同周期随原子序数递增电负性增大,Ga和As同周期,As的原子序数较大,故电负性较大的是As;As处于ⅤA族,同主族元素,随原子序数递增电负性减小,Ga、N、As电负性由大到小的顺序N>As>Ga,故答案为:N>As>Ga;
(3)根据结构示意图,As的价层电子对数=3+1=4,采用sp3杂化,1mol As4O6含有![]() 键的物质的量为3×4mol=12mol,故答案为:sp3;12;
键的物质的量为3×4mol=12mol,故答案为:sp3;12;
(4)AsH3和NH3形成的晶体均是分子晶体,其沸点受分子间作用力大小的影响,对于组成和结构相似的物质分子间作用力和其相对原子质量成正比,能够形成氢键的沸点升高,NH3分子间能形成氢键,AsH3分子间不能形成氢键,因此AsH3的沸点比NH3的沸点低,故答案为:低;AsH3分子间不能形成氢键,而NH3分子间能形成氢键;
(5)H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3 As,H3AsO3中的As为+3价,而H3AsO4中非羟基氧较多、As为+5价,正电性更高,导致As-O-H中的O的电子更向As偏移,越易电离出H+,故答案为:H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3 As,H3AsO3中的As为+3价,而H3AsO4中非羟基氧较多、As为+5价,正电性更高,导致As-O-H中的O的电子更向As偏移,越易电离出H+;
(6)①D与周围4个原子形成正四面体结构,D与顶点A的连线处于晶胞体对角线上,过面心B、C及上底面面心原子的平面且平行侧面将晶胞2等分,同理过D原子的且平平行侧面的平面将半个晶胞再2等份,可知D处于到各个面的![]() 处,则C原子的坐标参数为(
处,则C原子的坐标参数为(![]() ,
,![]() ,
,![]() ),故答案为:(
),故答案为:(![]() ,
,![]() ,
,![]() );
);
②1个晶胞中分别含有4个Li、Zn、As原子,1mol晶胞的质量为4×147g,1mol晶胞的体积为 (594×10-10)3NAcm3,则密度为![]() gcm-3,故答案为:
gcm-3,故答案为:![]() 。
。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案