题目内容
【题目】铁单质及其化合物在生活生产中应用广泛。
(1)硫酸铁可作絮凝剂,常用于净水,其原理是(用离子方程式表示)______________________。
(2)已知25°C时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数K=______________
Fe3++3H2O的平衡常数K=______________
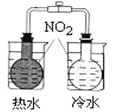
(3)电浮选凝聚法是工业上采用的一种污水处理方法,保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某研究小组设计装置如图所示。

①装置B中通入空气的电极反应是_______________
②装置A中,阳极的电极反应式分别为Fe-2e-=Fe2+、_______________
③实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣.此时,应向污水中加入适量的___________
a.H2SO4b.BaSO4c.Na2SO4d.NaOHe.CH3CH2OH
(4)工业催化剂K3[Fe(C2O4)3]·3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O。实验室由草酸亚铁晶体(FeC2O4·2H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备。
①制备过程要防止草酸被H2O2氧化,请写出草酸被H2O2氧化的化学方程式__________________。
②配合物的稳定性可以用稳定常数K来衡量,如Cu2+ + 4NH3![]() [Cu(NH3)4]2+,其稳定常数表达式为:
[Cu(NH3)4]2+,其稳定常数表达式为:![]() 。已知:[Fe(C2O4)3]3-的稳定常数K1=1020, Fe(SCN)3的稳定常数K2=2×103,请设计检验K3[Fe(C2O4)3]·3H2O中铁元素的方案_______________________。
。已知:[Fe(C2O4)3]3-的稳定常数K1=1020, Fe(SCN)3的稳定常数K2=2×103,请设计检验K3[Fe(C2O4)3]·3H2O中铁元素的方案_______________________。
【答案】 Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ 2.79×103 O2+2CO2+4e-=2CO32- 4OH--4e-=2H2O+O2 c H2C2O4+H2O2=2CO2↑+2H2O 取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液,若溶液呈血红色则有铁元素,反之则无。(未提及“加热”或“溶解在酸中”不得分)
Fe(OH)3(胶体)+3H+ 2.79×103 O2+2CO2+4e-=2CO32- 4OH--4e-=2H2O+O2 c H2C2O4+H2O2=2CO2↑+2H2O 取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液,若溶液呈血红色则有铁元素,反之则无。(未提及“加热”或“溶解在酸中”不得分)
【解析】试题分析:(1)铁离子水解出氢氧化铁胶体,所以常用于净水。
(2)根据平衡常数表达式与KSP、KW分析;(3)燃料电池中通入空气的电极是正极,通入甲烷的电极是负极。铁与正极相连作阳极,活泼金属电极做电解池的阳极时,电极本身失去电子,电极反应式为Fe-2e-=Fe2+,石墨与正极相连,石墨做阳极,氢氧根离子在阳极失电子;要保持保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀时,因此加入能使溶液导电能力增强的电解质必须是可溶于水的、显中性的盐;(4)草酸被H2O2氧化生成水和二氧化碳;根据温度常数,说明[Fe(C2O4)3]3-比Fe(SCN)3更稳定,所以不能直接滴加KSCN溶液,需要加热分解,然后酸溶,最后滴加KSCN溶液;
解析:(1)铁离子水解出氢氧化铁胶体,胶体具有吸附性,所以常用于净水,离子方程式为Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ ;(2)Fe(OH)3+3H+
Fe(OH)3(胶体)+3H+ ;(2)Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数K=
Fe3++3H2O的平衡常数K=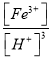 =
=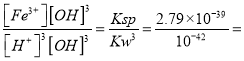 2.79×103;(3)燃料电池中通入空气的电极是正极,①正极电极反应是O2+2CO2+4e-=2CO32-。铁与正极相连作阳极,电极反应式为Fe-2e-=Fe2+;石墨电极的反应式4OH--4e-=2H2O+O2;要保持保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀时,因此加入能使溶液导电能力增强的电解质必须是可溶于水的、显中性的盐,所以选C;(4)草酸被H2O2氧化生成水和二氧化碳,方程式为H2C2O4+H2O2=2CO2↑+2H2O;根据温度常数,说明[Fe(C2O4)3]3-比Fe(SCN)3更稳定,检验K3[Fe(C2O4)3]·3H2O中铁元素,可以取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液,若溶液呈血红色则有铁元素,反之则无。
2.79×103;(3)燃料电池中通入空气的电极是正极,①正极电极反应是O2+2CO2+4e-=2CO32-。铁与正极相连作阳极,电极反应式为Fe-2e-=Fe2+;石墨电极的反应式4OH--4e-=2H2O+O2;要保持保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀时,因此加入能使溶液导电能力增强的电解质必须是可溶于水的、显中性的盐,所以选C;(4)草酸被H2O2氧化生成水和二氧化碳,方程式为H2C2O4+H2O2=2CO2↑+2H2O;根据温度常数,说明[Fe(C2O4)3]3-比Fe(SCN)3更稳定,检验K3[Fe(C2O4)3]·3H2O中铁元素,可以取适量晶体加热,取固体残留物溶解在H2SO4中,取上层清液于试管中,滴加KSCN溶液,若溶液呈血红色则有铁元素,反之则无。

【题目】图中UZ六种物质在适当条件下能实现图示箭头方向一步转化,且反应①、②均为置换反应,满足条件的物质组是( )
序号 | U | W | Y | X |
|
① | Na | H2O | Na2O2 | NaOH | |
② | Fe | H2O | C | H2 | |
③ | HBr | Cl2 | CH4 | HCl | |
④ | CuCl2(aq) | Al | HCl(aq) | AlCl3(aq) |
A. ②④ B. ②③ C. ①②④ D. ①②③④