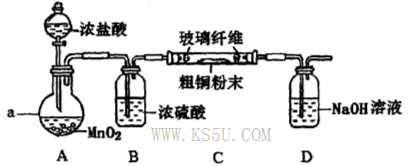
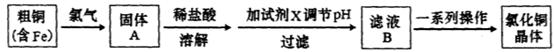题目内容
向Fe和Fe2O3的混合物中加入足量的稀硫酸,充分反应后生成FeSO4溶液,当生成的Fe2+和H2的物质的量之比为5︰2时,则Fe和Fe2O3的物质的量之比为
| A.3︰1 | B.1︰2 | C.2︰1 | D.1∶1 |
A
试题分析:假设n(H2)=2mol,则由反应:Fe+ H2SO4= FeSO4+H2↑。消耗的Fe为2mol,产生的Fe2+的物质的量为2mol.由方程式Fe2O3+3H2SO4=2Fe2(SO4)3+3H2O和Fe+2Fe2(SO4)3=3FeSO4.可得关系式Fe——Fe2O3—3Fe2+. Fe2+是3mol,所以n(Fe)=1mol,n(Fe2O3)=1mol.因此原固体中Fe和Fe2O3的物质的量之比为3:1.选项为A.2O3的混合物与硫酸反应的知识。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目

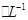 ,则此溶液最多能溶解铁粉的质量为
,则此溶液最多能溶解铁粉的质量为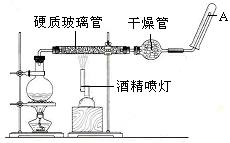
 3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。
3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。