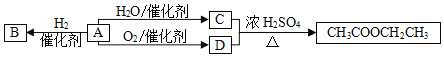
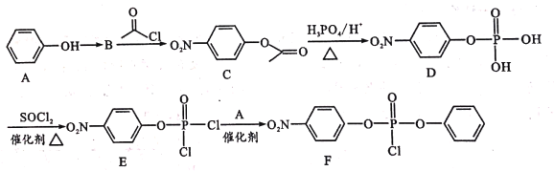
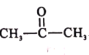
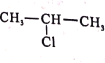
题目内容
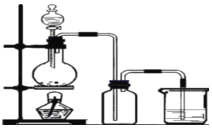
【题目】实验室制备氯气并检验氯气性质实验的装置如图。请回答:
(1)分液漏斗中盛放的液体是_____;写出圆底烧瓶中发生的反应的化学方程式_____。
(2)在集气瓶中放入湿润的红布条,滴加液体到烧瓶中,并点燃酒精灯,一段时间后集气瓶中观察到的现象是_____,烧杯中的液体是_____。
【答案】浓盐酸 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 褪色 NaOH溶液
MnCl2+Cl2↑+2H2O 褪色 NaOH溶液
【解析】
实验室利用二氧化锰和浓盐酸加热制取氯气,制出的氯中混有HCl和水蒸染质,需要通过饱和食盐水除去HCl杂质,再通过浓硫酸干燥除水,再收集,最后通过氢氧化钠溶液进行尾处理。
(1)用浓盐酸和MnO2制取氯气,液体浓盐酸盛放在分液漏斗中,MnO2盛放在烧瓶中,打开分液漏斗活塞,加入浓盐酸,加热,生成氯气、二氧化锰和水,化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:浓盐酸;MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:浓盐酸;MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)Cl2和H2O生成HCl和HClO,HClO有强氧化性,能使湿润的红布条褪色,但Cl2有毒,会污染空气,常用NaOH溶液反应吸收,故答案为:褪色;NaOH溶液。

练习册系列答案
相关题目