题目内容
【题目】已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大。A的一种质量数为14的原子常用来测定文物的年代;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d64s2。
(1)A、B、C、D四种元素中,电负性最大的是_______________(填元素符号)。
(2)等电子体具有相似的结构和性质。AC与B2、AC2与CAB-均互为等电子体,则AC的电子式为_________。CAB-中A原子的杂化方式为_________。,E能与AC分子形成E(AC)5,其原因是AC分子中含有______________________。
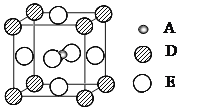
(3)最近发现,只含A、D、E三种元素的一种晶体(晶胞如图所示)具有超导性。A原子的配位数为___________;该晶体的化学式为___________。
(4)已知C、E形成的一种晶体ExC,晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知该晶体密度为ρ=3.53g/cm3,晶胞边长为5.0×10-10m。则该晶体中x值(精确至0.1)为_______。晶体中的Fen+分别为Fe2+、Fe3+,则Fe2+与Fe3+的比值为_______。
【答案】O ![]() sp 孤对电子 6 MgFe3C 0.9 2:7
sp 孤对电子 6 MgFe3C 0.9 2:7
【解析】
根据![]() 可用来测定文物年代,则A为C元素;根据C的基态原子2p能级上的未成对电子数与A原子相同,C为O元素;依据A、B、C、D、E原子序数逐渐增大,可知B为N元素;C2-离子D2+离子具有相同的、稳定的电子层结构,则D是Mg元素;E的基态原子的外围电子排布式为3d64s2,则E是Fe元素,据此解答。
可用来测定文物年代,则A为C元素;根据C的基态原子2p能级上的未成对电子数与A原子相同,C为O元素;依据A、B、C、D、E原子序数逐渐增大,可知B为N元素;C2-离子D2+离子具有相同的、稳定的电子层结构,则D是Mg元素;E的基态原子的外围电子排布式为3d64s2,则E是Fe元素,据此解答。
由以上分析可知:A为C元素;B为N元素;C为O元素;D为Mg元素;E是Fe元素。
(1)A、B、C、D四种元素中,O的非金属性最强,元素的非金属性越强,其电负性越强,故O元素的电负性最强;
(2)AC与B2互为等电子体,即CO与N2互为等电子体,氮气的结构式为N≡N,则CO的结构式为:![]() ,电子式为
,电子式为![]() ;AC2与CAB-均互为等电子体,CO2与CNO-互为等电子体,等电子体的杂化方式相同,已知CO2分子中C原子杂化类型为sp杂化,则CNO-中C原子也是sp杂化;Fe能与CO分子形成Fe(CO)5,该化合物属于配合物,其中CO分子中C原子提供孤对电子,Fe原子提供空轨道;
;AC2与CAB-均互为等电子体,CO2与CNO-互为等电子体,等电子体的杂化方式相同,已知CO2分子中C原子杂化类型为sp杂化,则CNO-中C原子也是sp杂化;Fe能与CO分子形成Fe(CO)5,该化合物属于配合物,其中CO分子中C原子提供孤对电子,Fe原子提供空轨道;
(3)由图可以看出A原子的配位数为6,该晶体的化学式为可以用均摊法求算,C原子在晶胞内部原子数为:1,Mg在晶胞顶点上原子数为:![]() ×8=1,Fe原子在面心上原子数数为:
×8=1,Fe原子在面心上原子数数为:![]() ×6=3,则化学式为:MgFe3C;
×6=3,则化学式为:MgFe3C;
(4)FexO晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个FexO,根据密度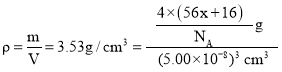 ,解得x=0.9,设Fe0.9O中Fe2+的数目为a,Fe3+的数目为b,结合化合物中化合价代数和为零可得a+b=0.9,2a+3b=2,解得a=0.7,b=0.2,则Fe2+与Fe3+的比值为2:7。
,解得x=0.9,设Fe0.9O中Fe2+的数目为a,Fe3+的数目为b,结合化合物中化合价代数和为零可得a+b=0.9,2a+3b=2,解得a=0.7,b=0.2,则Fe2+与Fe3+的比值为2:7。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是有关物质的Ksp:
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
Ksp(单位省略) | 2.8×10-9 | 6.8×10-6 | 4.7×10-6 | 5.6×10-12 |
回答下列问题:
(1)___(填“能”或“不能”)直接把贝壳研磨成粉末撒入海水中,使Mg2+转化为MgCO3沉淀,原因是_______。
(2)实际生产中是把Mg2+转化为Mg(OH)2沉淀,而不是转化为MgCO3沉淀,原因是______,请你推测应将贝壳进行怎样的加工处理_____。
(3)某同学在实验室条件下模拟该生产过程,在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他_____(填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是__________。
(4)要制得无水MgCl2,过滤出Mg(OH)2沉淀后,用试剂_____(填化学式)将其溶解,选择该试剂的理由是__________。
(5)将得到的氯化镁溶液在浓缩池中制得MgCl2·6H2O。然后将MgCl2·6H2O转移到干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O,才能得到无水MgCl2,原因是_______。