题目内容
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:
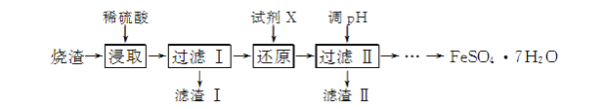
(1) 滤渣Ⅰ的主要成分是________(填化学式),滤渣Ⅱ的主要成分是________(填化学式)。
(2) 试剂X常选用SO2,写出“还原”过程中发生反应的离子方程式:________。
(3) 从分离出滤渣Ⅱ后的滤液中得到产品,应进行的操作是蒸发浓缩、________、过滤、洗涤、干燥。
(4) FeSO4·7H2O在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a:取8片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配制成250 mL溶液;
步骤b:取上述溶液25 mL于锥形瓶中,加入少量硫酸酸化,逐渐滴加0.010 0 mol·L-1的KMnO4溶液,反应为5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O。记录滴定终点时消耗KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应)。
步骤c:重复“步骤b”2~3次,平均消耗KMnO4溶液20.00 mL。
① 步骤a中配制250 mL溶液需要的玻璃仪器有烧杯、玻璃棒、________、胶头滴管。
② 该补血剂中亚铁离子的含量为________mg/片(请写出计算过程)。
【答案】SiO2 Al(OH)3 2Fe3++SO2+2H2O===2Fe2++SO42-+4H+ 冷却结晶 250 mL容量瓶 25 mL溶液中:n(Fe2+)=5n(MnO4-)=5×0.010 0 mol·L-1×20.00×10-3 L=1.000 0×10-3 mol,250 mL溶液中:n(Fe2+)=1.000 0×10-3 mol×10=1.000 0×10-2 mol,1片补血剂样品中:m(Fe2+)=1.000 0×10-2 mol×56 g·mol-1/8= 0.070 0 g= 70mg
【解析】
用硫铁矿焙烧去硫的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3)制取七水合硫酸亚铁(FeSO4·7H2O)过程中,中心元素是铁。故制备过程中必须除去杂质SiO2、Al2O3,并将三价铁还原为亚铁,据此分析解答相关问题。
(1) 用稀硫酸浸取烧渣时,只有SiO2不溶,过滤I所得滤渣Ⅰ的主要成分是SiO2,滤液中主要含有Fe2(SO4)3、FeSO4、Al2(SO4)3等。试剂X将Fe3+还原为Fe2+,调节pH后过滤II所得滤渣II为Al(OH)3,滤液为FeSO4溶液。
(2) 用SO2将Fe3+还原为Fe2+,本身被氧化为SO42-,可以写出反应的离子方程式2Fe3++SO2+2H2O===2Fe2++SO42-+4H+。
(3) 过滤Ⅱ所得滤液为FeSO4溶液,要得到产品FeSO4·7H2O晶体,应将滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4) ①配制250 mL溶液需要的玻璃仪器有烧杯、玻璃棒、250 mL容量瓶、胶头滴管。
②据5Fe2+ ~ MnO4-,25 mL溶液中
n(Fe2+)=5n(MnO4-)=5×0.010 0 mol·L-1×20.00×10-3 L=1.000 0×10-3 mol
则250 mL溶液中,n(Fe2+)=1.000 0×10-3 mol×10=1.000 0×10-2 mol
1片补血剂样品中,m(Fe2+)=1.000 0×10-2 mol×56 g·mol-1/8= 0.070 0 g=70mg

【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备FeCO3的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4溶液 (pH=4.5) | 1 mol/L Na2CO3溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min后出现明显的红褐色 |
0.8 mol/L FeSO4溶液 (pH=4.5) | 1 mol/L NaHCO3溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验I中红褐色沉淀产生的原因可用如下反应表示,请补全反应:_____________
![]() Fe2++
Fe2++ ![]() +
+ ![]() +
+ ![]() H2O
H2O ![]()
![]() Fe(OH)3 +
Fe(OH)3 + ![]() HCO3
HCO3
(2)实验II中产生FeCO3的离子方程式为__________________。
(3)为了探究实验III中NH4+所起的作用,甲同学设计了实验IV进行探究:
操作 | 现象 | |
实验IV | 向0.8 mol/L FeSO4溶液中加入________,再加入一定量Na2SO4固体配制成混合溶液(已知Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与2mL 1mol/L NaHCO3溶液混合 | 与实验III现象相同 |
实验IV中加入Na2SO4固体的目的是_________。
对比实验II、III、IV,甲同学得出结论:NH4+水解产生H+,降低溶液pH,减少了副产物Fe(OH)2的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:_________,再取该溶液一滴管,与2mL 1mol/L NaHCO3溶液混合。
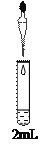
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验III中FeCO3的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验I、II、III中的沉淀进行过滤、洗涤、干燥后称量,然后转移至A处的广口瓶中。

① 补全A中装置并标明所用试剂。____________
② 为测定FeCO3的纯度,除样品总质量外,还需测定的物理量是____________。
(5)实验反思:经测定,实验III中的FeCO3纯度高于实验I和实验II。通过以上实验分析,制备FeCO3实验成功的关键因素是____________。