题目内容
氯气在工业上有着重要的用途,某兴趣小组在实验室中用下列装置模拟工业上用氯气制备无水氯化铝(183℃时升华,遇潮湿空气即产生大量白雾)。

 请回答下列问题:
请回答下列问题:
(1)装置 B 中盛放饱和食盐水,其作用是 。F 中盛放的是 ,其作用是 。用一件仪器装填适当试剂后也可起到 F 和 G 的作用,所装填的试剂为 。
(2)装置 A 实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
A.往烧瓶中加入 MnO2 粉末 B.加热 C.往烧瓶中加入浓盐酸
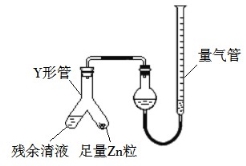
(3)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学 提出很多实验方案,其中方案之一为让残留的液体与足量 Zn 反应,测量生成的 H2体积。 装置如图所示(夹持器具已略去)。反应完毕,每间隔 1 分钟读取气体体积、气体体积逐渐减小,直至不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)。
(4)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量 ClO2 生成;ClO2 沸点为 10 ℃,熔点为?59 ℃,液体为红色;Cl2 沸点为?34 ℃,液态为黄绿色。设计最简单的实验验证 Cl2中含有 ClO2: 。
练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目


 2SO3(g) ΔH = a kJ·mol-1,反应能量变化如图所示。下列说法中,不正确的是
2SO3(g) ΔH = a kJ·mol-1,反应能量变化如图所示。下列说法中,不正确的是

 ________,挖出后在空气中容易发黄的原因______________。
________,挖出后在空气中容易发黄的原因______________。
 = ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
= ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。