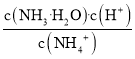题目内容
【题目】二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) ΔH1=-131.0kJ·mol-1
CH3OH(l)+H2O(l) ΔH1=-131.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) ΔH2=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH2=-285.8kJ·mol-1
则CH3OH的燃烧热ΔH=__。
(2)在催化剂作用下,CO2和CH4可以直接转化为乙酸:CO2(g)+CH4(g)![]() CH3COOH(g) ΔH=+36.0kJ·mol-1
CH3COOH(g) ΔH=+36.0kJ·mol-1
欲使乙酸的平衡产率提高,应采取的措施是__(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(3)高温下,CO2与足量的碳在密闭容器中实现反应:C(s)+CO2(g)![]() 2CO(g)。
2CO(g)。
①该反应的平衡常数表达式K=__。
②向容积为1L的恒容容器中加入足量的碳和0.2molCO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示。
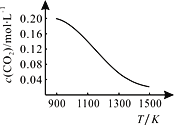
则该反应为__(填“放热”或“吸热”)反应。某温度下,若向该平衡体系中再通入0.2molCO2,达到新平衡后,体系中CO的百分含量__(填“变大”或“变小”或“不变”),平衡常数__(填“变大”或“变小”或“不变”)。
【答案】-726.4kJ·mol-1 AC ![]() 吸热 减小 不变
吸热 减小 不变
【解析】
(1)CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) ΔH1=-131.0kJ·mol-1 ①
CH3OH(l)+H2O(l) ΔH1=-131.0kJ·mol-1 ①
H2(g)+![]() O2(g)=H2O(l) ΔH2=-285.8kJ·mol-1 ②
O2(g)=H2O(l) ΔH2=-285.8kJ·mol-1 ②
②×3-①即可得出CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH2=-726.4kJ·mol-1。
O2(g)=CO2(g)+2H2O(l) ΔH2=-726.4kJ·mol-1。
答案为:-726.4kJ·mol-1;
(2)因为正反应吸热,所以应升温使平衡向正反应方向进行;因为反应物气体分子数大于生成物,所以应加压使平衡向正反应方向进行,从而提高平衡产率。答案为:AC;
(3)①根据方程式可知该反应的平衡常数表达式K=![]() 。答案为:
。答案为:![]() ;
;
②从图象中可以看出,温度升高,c(CO2)减小,则表明平衡正向移动,由此可得出该反应为吸热反应。某温度下,若向该平衡体系中再通入0.2molCO2,相当于加压,平衡逆向移动,达到新平衡后,体系中CO的百分含量减小;虽然平衡发生移动,但温度不变,平衡常数不变。答案为:吸热;减小;不变。

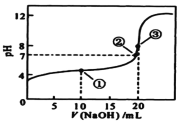
【题目】海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mgL-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示):____________,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。

① 开始时阳极的电极反应式为________________。
② 电解一段时间,____极(填“阴”或“阳”)会产生水垢,其成份为_____(填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:

该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示_____(填粒子符号),充电时该电极反应式为_______。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为_________(空气中氧气的体积分数按20%计)。