题目内容
【题目】I.某学生利用下图装置测定反应过程中所放出的热量并计算中和热。所用药品为50ml 0.50mol·L-1盐酸与50ml 0.55mol·L-1NaOH溶液。请回答下列问题:
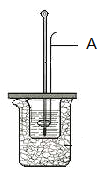
(1)图中A仪器名称为__________。其作用为__________。
(2)该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是____________。
A.测量盐酸的温度后,温度计没有用水冲洗干净,立即去测量氢氧化钠溶液的温度
B.把量筒中的氢氧化钠溶液一次性快速倒入小烧杯
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
II.(1)原电池是将化学能转化为电能的装置,现将下列化学反应设计成带盐桥原电池,请你画出该原电池装置简图(标明电极材料名称和试剂名称):Zn+CuSO4= ZnSO4+Cu_________
(2)盐桥中的阴离子向_________(填正极或负极)迁移。
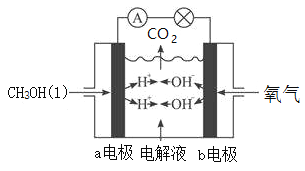
III.下图为甲醇(CH3OH)燃料电池装置,该装置能量转化率可达90%,当通入67.2L(标况下)氧气时,产生1306kJ电能,则甲醇液体的燃烧热的热化学方程式为____________。
【答案】 环形玻璃搅拌棒 使反应液搅拌均匀,充分反应 A、D 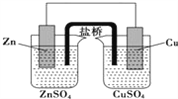 负极 CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.6kJ/mol
负极 CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.6kJ/mol
【解析】本题分析:本题主要考查测定中和热。
I.(1)图中A仪器名称为环形玻璃搅拌棒。其作用为将反应液搅拌均匀,充分反应。
(2)A.氢氧化钠溶液的温度偏高,中和热的数值偏低;B.操作正确,不影响中和热的测定结果;C.不影响中和热的测定结果;D.氨水电离吸热,中和热的测定结果偏低。故选A、D。
II.(1)原电池装置简图(标明电极材料名称和试剂名称): 。
。
(2)盐桥中的阴离子向负极迁移。
III.当通入67.2L(标况下)即3mol氧气时,产生1306kJ电能,则甲醇液体的燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-1306kJ/2/90%kJ/mol=-725.6kJ/mol。

【题目】下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | B | C | D | |||||
3 | E | F | G | H | I | J |
(1)表中元素,化学性质最不活泼的是__________,只有负价而无正价的是__________, 可用于制半导体材料的元素是_______。
(2)A分别与B、C、G、H形成的简单化合物中,最稳定的是__________,其中A和C形成的化合物溶于水,再向其中滴加酚酞溶液,会观察到________________。
(3)E、F、I元素形成的简单离子中,半径最大的是__________。
(4)写出F的单质与氢氧化钠溶液反应的化学方程式_________________。
