题目内容
【题目】碳、氮元素及其化合物与生产、生活密切相关,回答下列问题。
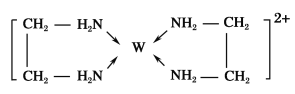
(1)某有机物的结构简式如图。该有机物分子是___(填“极性”或“非极性”)分子,该有机物分子中电负性最大的原子为___。
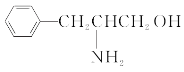
(2)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为___,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因是__。
【答案】极性 O sp3 乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键
【解析】
(1)根据分子的对称性判断分子的极性,根据元素周期律比较电负性大小;
(2)杂化轨道用于形成σ键和容纳孤电子对,分子间形成氢键会使沸点升高。
(1)该有机物分子结构不对称,分子中正负电中心不重合,为极性分子;该有机物中含有C、H、O、N四种元素,同周期从左到右元素的电负性逐渐增大,元素的非金属性越强电负性越大,则电负性最大的是O;
(2)乙二胺分子中每个氮原子形成三个σ键,孤电子对数为1,故为sp3杂化;乙二胺分子中存在N—H键,乙二胺分子间能形成氢键,三甲胺分子中氢原子与电负性较小的碳原子相连,分子间不能形成氢键,所以乙二胺比三甲胺的沸点高很多。

【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
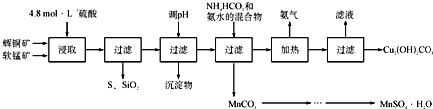
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0molL-1计算):
开始沉淀的pH | 沉淀完全的pH | |
Fe 3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有____________________(任写一点);
(2)调节浸出液pH的范围为____________,其目的是_______________________;
(3)本工艺中可循环使用的物质是____________________(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成_________________的结果;
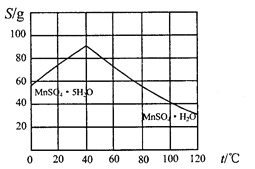
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示,现由硫酸锰溶液制备MnSO4·H2O的实验方案为____________________。
(6)用标准BaCl2溶液测定样品中MnSO4H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_________________(任写一种)。