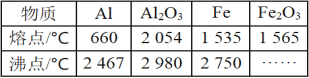
题目内容
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) △H>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图。下列说法不正确的是( )
4NO2(g)+O2(g) △H>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图。下列说法不正确的是( )
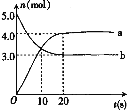
A.0~20s内,平均反应速率v(N2O5)=0.05 mol·L-1·s-1
B.升高温度,可使正逆反应速率均增大
C.达到平衡时,混合气体的压强保持不变
D.10 s时,正、逆反应速率相等
【答案】D
【解析】
A. 由图可知b曲线为反应物(N2O5)的物质的量的变化关系,0~20s内物质的量的变化量为2.0mol,v=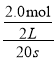 =0.05 mol·L-1·s-1,A项正确;
=0.05 mol·L-1·s-1,A项正确;
B.升高温度,正逆反应速率均增大,B项正确;
C. 当反应达到平衡状态时,正逆反应速率相等,混合气体的压强保持不变,C项正确;
D. 由图可知,10s时,反应物和某种生成物的物质的量相等,不能证明正逆反应速率相等,D项错误;
答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目