题目内容
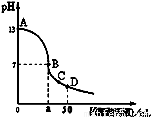
 在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如图所示,有关粒子浓度关系比较不正确的( )
在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如图所示,有关粒子浓度关系比较不正确的( )| A、在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | B、在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) | C、在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | D、在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
分析:在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol?L-1 CH3COOH 溶液,二者之间相互反应,当恰好完全反应时,所需醋酸的体积为12.5mL,当反应至溶液显中性时,醋酸应稍过量,且c(OH-)=c(H+),注意根据电荷守恒思想来比较离子浓度大小.
解答:解:A、在A、B间任一点,溶液中只存在四种离子有:Na+、H+、CH3COO-、OH-,根据电荷守恒则有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),而c(H+)<c(OH-),所以溶液中离子浓度大小关系为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故A正确;
B、在B点溶液显中性,a>12.5,则结果是c(OH-)=c(H+),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则一定有c(Na+)=c(CH3COO-),溶液的成分为:反应生成的醋酸钠和剩余的醋酸,醋酸钠的水解程度和醋酸的电离程度相等,故有:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故B错误;
C、在C点,溶液显酸性,故有c(OH-)<c(H+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)<c(CH3COO-),c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
D、在D点时,醋酸剩余,剩余的醋酸的浓度和生成的醋酸钠浓度相等均为0.05mol/l,根据物料守恒,则:c(CH3COO-)+c(CH3COOH)=0.1mol?L-1,c(Na+)=0..05mol/L,c(CH3COO-)+c(CH3COOH)=2c(Na+)故D正确;
故选:B.
B、在B点溶液显中性,a>12.5,则结果是c(OH-)=c(H+),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则一定有c(Na+)=c(CH3COO-),溶液的成分为:反应生成的醋酸钠和剩余的醋酸,醋酸钠的水解程度和醋酸的电离程度相等,故有:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故B错误;
C、在C点,溶液显酸性,故有c(OH-)<c(H+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)<c(CH3COO-),c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
D、在D点时,醋酸剩余,剩余的醋酸的浓度和生成的醋酸钠浓度相等均为0.05mol/l,根据物料守恒,则:c(CH3COO-)+c(CH3COOH)=0.1mol?L-1,c(Na+)=0..05mol/L,c(CH3COO-)+c(CH3COOH)=2c(Na+)故D正确;
故选:B.
点评:本题考查酸碱混合溶液的定性分析,题目难度较大,注意从电解质的强弱以及酸碱混合反应的角度分析,注意分析曲线的变化特点.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
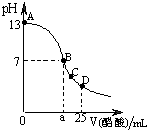
 在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的 ( )
在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的 ( )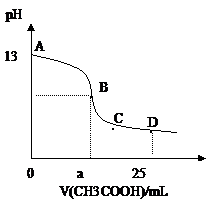 A.B点的横座标a==12.5,且有c(Na+)==c(CH3COO—)
A.B点的横座标a==12.5,且有c(Na+)==c(CH3COO—)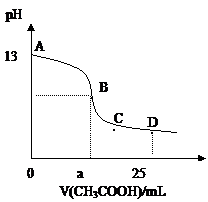 A.B点的横座标a==12.5,且有c(Na+)==c(CH3COO—)
A.B点的横座标a==12.5,且有c(Na+)==c(CH3COO—)