题目内容
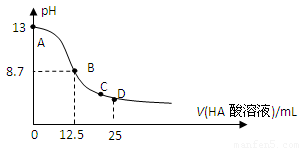
25℃时,在25mL0.1mol/L的氢氧化钠溶液中,逐滴加入0.2mol/LCH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是
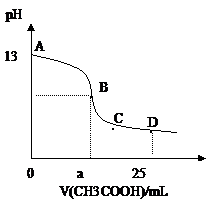 A.B点的横座标a==12.5,且有c(Na+)==c(CH3COO—)
A.B点的横座标a==12.5,且有c(Na+)==c(CH3COO—)
B.C点时,c(CH3COO—)>c(Na+)>c(H+)= c(OH—)
C.D点时,c(CH3COO—)+ c(CH3COOH)==2c(Na+)
D.对曲线上A、B间任何一点,溶液中都有:
c(Na+)>c(CH3COO—)>c(OH—) >c(H+)
C
解析:
A不对,因二者刚好反应时,由于生成物水解,溶液呈碱性,故c(Na+)不等于c(CH3COO—);B不对,当c(H+)= c(OH—)时,根据电荷守恒c(Na+)==c(CH3COO—);C正确,根据物料守恒;D不对,初始阶段 c(OH—) > c(CH3COO—)

练习册系列答案
相关题目
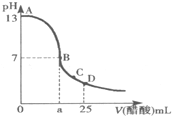 25℃时,在25mL 0.1mol?L-1的NaOH溶液中,逐滴加入0.2mol?L-1的CH3COOH溶液,溶液的pH与醋酸体积关系如图,下列分析正确的是( )
25℃时,在25mL 0.1mol?L-1的NaOH溶液中,逐滴加入0.2mol?L-1的CH3COOH溶液,溶液的pH与醋酸体积关系如图,下列分析正确的是( )