题目内容
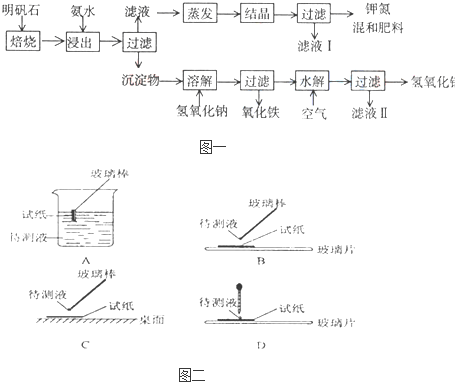
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500 mL稀氨水(每升含有39.20 g氨)需要取浓氨水(每升含有251.28 g氨)__________mL,用规格为__________mL量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是_________________________________________________________________。
(3)写出沉淀物中所有物质的化学式___________________________________。
(4)滤液Ⅰ的成分是水和______________________。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量__________溶液,产生白色沉淀。
②__________、__________、__________(依次填写实验操作名称)。
③冷却、称重。
(6)若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为__________mol(用含有m、n的代数式表示)。
(1)78 100
(2)取滤液少许,加入NaOH溶液,加热,生成的气体能使湿润的红色石蕊试纸变蓝
(3)Al(OH)3、Al2O3和Fe2O3
(4)K2SO4、(NH4)2SO4
(5)①BaCl2[或Ba(NO3)2] ②过滤 洗涤 干燥
(6)
【解析】
试题分析:(1)根据稀释前后溶质的质量不变得:0.5 L×39.20 g·L-1=V×251.28 g·L-1,V=0.078 L=78 mL。为了减少误差,最好选用比氨水的实际体积稍大一点的量筒。
(2)NH4+的检验方法是:先往NH4+中加入强碱,使之转化为NH3,然后检验NH3即可。
(3)Al3++3NH3·H2O=Al(OH)3↓+3NH4+,根据题意,明矾石中含有Al2O3、Fe2O3,所以沉淀物为Al(OH)3、Al2O3和Fe2O3。
(4)由于明矾石的组成与明矾相似,所以滤液的成分中含有K2SO4和反应后生成的(NH4)2SO4以及水。
(5)混合肥料中含有K2SO4和(NH4)2SO4,要产生白色沉淀,加入的溶液为BaCl2或Ba(NO3)2溶液,以后的操作为:先将混合液过滤,然后洗涤,最后干燥,冷却后称量。
(6)根据题意有:174n(K2SO4)+132n[(NH4)2SO4]=m g……①再由SO42-守恒得:n(K2SO4)+n[(NH4)2SO4]=n mol……②,两式联立可解得n(K2SO4)=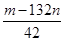 mol。
mol。
考点:本题考查化学工艺流程的分析、仪器的选择和基本操作、产物的判断、化学计算。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案