题目内容
原子序数由小到大排列的五种短周期元素X、Y、Z、M、W,其中X、Z、M、W四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,元素Y原子的最外层电子数是其电子层数的2倍,Z、M左右相邻,M、W位于同主族。
(1)元素W在周期表中的位置是 。W的阴离子结构示意图是 ;
(2)元素Z的单质的电子式为 。标况下,试管中收集满Z的氢化物,倒立于水中(溶质不扩散),一段时间后,试管内溶液的物质的量浓度为 。
(3)元素Y常见的同素异形体有 。 Y最高价氧化物中的化学键类型为 。Y的氢化物中含氢量最高的物质是常见的燃料,1g该燃料燃烧产生CO2(g)和H2O(l)时放热55.6kJ,试写出表示该燃料燃烧热的热化学反应方程式
。
(4)由X、Z、M、W四种元素中的三种组成的一种强酸,该酸的稀溶液能与铜反应,离子方程式为 。
(5)由X、Z、、M、W和Fe五种元素组成的摩尔质量为392g/ mol的化合物甲,1 mol甲中含有6mol结晶水。对化合物甲进行如下实验:
a.取甲的溶液加入过量的浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b.另取甲的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①甲的化学式为 。
② 已知100mL 1 mol/L 的甲溶液能与20mL 1mol/L的酸性KMnO4溶液恰好反应。写出反应的离子方程式 。
(1)元素W在周期表中的位置是 。W的阴离子结构示意图是 ;
(2)元素Z的单质的电子式为 。标况下,试管中收集满Z的氢化物,倒立于水中(溶质不扩散),一段时间后,试管内溶液的物质的量浓度为 。
(3)元素Y常见的同素异形体有 。 Y最高价氧化物中的化学键类型为 。Y的氢化物中含氢量最高的物质是常见的燃料,1g该燃料燃烧产生CO2(g)和H2O(l)时放热55.6kJ,试写出表示该燃料燃烧热的热化学反应方程式
。
(4)由X、Z、M、W四种元素中的三种组成的一种强酸,该酸的稀溶液能与铜反应,离子方程式为 。
(5)由X、Z、、M、W和Fe五种元素组成的摩尔质量为392g/ mol的化合物甲,1 mol甲中含有6mol结晶水。对化合物甲进行如下实验:
a.取甲的溶液加入过量的浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b.另取甲的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①甲的化学式为 。
② 已知100mL 1 mol/L 的甲溶液能与20mL 1mol/L的酸性KMnO4溶液恰好反应。写出反应的离子方程式 。
(1)第三周期第VIA族(1分) 。 S2-的:+16 2 8 8 (1分) ;
(2) :N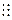 N : (1分) 。 0.045mol/L (1分) 。
N : (1分) 。 0.045mol/L (1分) 。
(3)石墨、金刚石、C60(答对两个给满分1分)。 极性共价键或共价键(1分)。
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H="-899.6kJ/mol " (2分) 。
(4) 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O (2分) 。
(5)① (NH4)2Fe(SO4)2·6H2O(1分) 。
② 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O (2分)。
(2) :N
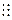 N : (1分) 。 0.045mol/L (1分) 。
N : (1分) 。 0.045mol/L (1分) 。(3)石墨、金刚石、C60(答对两个给满分1分)。 极性共价键或共价键(1分)。
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H="-899.6kJ/mol " (2分) 。
(4) 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O (2分) 。
(5)① (NH4)2Fe(SO4)2·6H2O(1分) 。
② 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O (2分)。
略

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目