题目内容
【题目】下列说法正确的是( )
A. 凡是能导电的物质都是电解质
B. 电解质溶液能导电的原因是溶液中有自由移动的离子
C. 盐酸能导电的原因是溶液在电流作用下电离生成了自由移动的离子的缘故
D. 凡是能电离的物质一定能导电
【答案】B
【解析】A. 凡是能导电的物质不一定都是电解质,例如金属,A错误;B. 电解质溶液能导电的原因是溶液中有自由移动的离子,B正确;C. 盐酸能导电的原因是溶液电离生成了自由移动的离子的缘故,电离不需要通电,C错误;D. 能电离的物质不一定发生了电离,要在水溶液里或熔化状态下才能电离,故不一定能能导电,例如固体氯化钠等,D错误,答案选B。

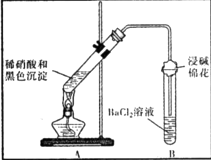
【题目】某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为 .
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是 .
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
装置 | 现象 | 结论及解释 |
| ①A试管中黑色沉淀逐渐溶解 | a.现象②说明褐色沉淀具有 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释: .
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2 , 过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为 .
【题目】如图装置可用于收集气体X并验证其某些化学性质,你认为不正确的是( ) 
选项 | 气体 | 试剂 | 现象 | 结论 |
① | SO2 | 酸性高锰酸钾溶液 | 溶液褪色 | SO2有漂白性 |
② | NH3 | 滴有紫色石蕊的盐酸 | 溶液变蓝 | 氨水显碱性 |
③ | CO2 | 氯化钡溶液 | 溶液变浑浊 | 碳酸钡难溶于水 |
④ | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
A.③④
B.②④
C.①②
D.全部