��Ŀ����
����Ŀ���±�ΪԪ�����ڱ���һ���֣��û�ѧ����ش��������⣺
���� ���� | I | II | III | IV | V | VI | VII |
һ | �� | ||||||
�� | �� | �� | �� | ||||
�� | �� | �� | �� | �� | �� | �� |
(1)���ԭ�ӽṹʾ��ͼΪ________________��
(2)�ܺ͢������ڱ��е�λ�÷ֱ���________________��________________��
(3)�ں͢���̬�⻯���ȶ��ԵĴ�С˳��________________(�ѧʽ)��
(4)�ۢ�����ۺ������������ǿ����________________(�ѧʽ)��
(5)�۵���̬�⻯����۵�����������Ӧ��ˮ���ﷴӦ���ɵ�����__(�ѧʽ)������___(�������ۻ��������������ӻ�������)��
(6)�٢ܢ�����Ԫ�ص�ԭ�����γ�ԭ����Ŀ��Ϊ1��1��1�Ĺ��ۻ�������ĵ���ʽΪ_____��
(7)���ȽϢܺ͢�����Ԫ�صķǽ�����ǿ����������Ϊ��֤��֤����_____(����ĸ)��
A���Ƚ�������Ԫ�ص��ʵķе�
B���Ƚ�������Ԫ�ص������������ϵ���
C���Ƚ�������Ԫ�ص�����������Ӧˮ����������
D���Ƚ�������Ԫ�ص��������Ӧ��������
���𰸡�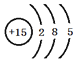 �ڶ����ڣ���VIA�� �������ڣ���VA�� NH3>CH4 HClO4 NH4NO3 ���ӻ�����
�ڶ����ڣ���VIA�� �������ڣ���VA�� NH3>CH4 HClO4 NH4NO3 ���ӻ����� ![]() B
B
��������
����Ԫ�������ڱ��е����λ�ÿ�֪�١���ֱ���H��C��N��O��Na��Mg��Al��P��S��Cl��
(1)��ΪPԪ�أ�ԭ�ӽṹʾ��ͼΪ�� ��
��
(2)��ΪOԪ�أ������ڱ��е�λ���ǵڶ����ڣ���VIA�壬��ΪPԪ�أ������ڱ��е�λ���ǵ������ڣ���VA�壻
(3)�ں͢�����ͬ���ڣ��������ҷǽ�������ǿ������̬�⻯���ȶ��Դ�С˳����NH3��CH4��
(4)�ۡ��ࡢ��ķǽ�������ǿ����Cl������ۺ������������ǿ����HClO4��
(5) �۵���̬�⻯���ǰ������۵�����������Ӧ��ˮ���������ᣬ���߷�Ӧ����ʽNH3+HNO3=NH4NO3����������Σ��������ӻ����
(6)�١��ܡ�������Ԫ�ص�ԭ�����γ�ԭ����Ŀ��Ϊ1:1:1�Ĺ��ۻ�������HClO������ʽΪ![]() ��
��
(7)A��Ԫ�ص��ʵķе㲻�������ȽϷǽ�����ǿ����A����
B��Ԫ�ص�������������Խ���ף��ǽ�����Խǿ��B��ȷ��
C����Ԫ��û�����������ˮ���C����
D��Ԫ�ص��������Ӧ�������ԣ����������ȽϷǽ�����ǿ����D����
��ѡB��

 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
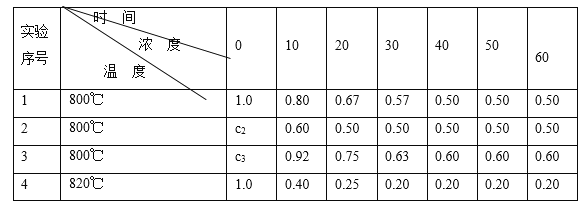
â���̸����������������ϵ�д�����Ŀ����һ�������£�N2O�ֽ�IJ���ʵ���������£� ��
��Ӧʱ��/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c��N2O��/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
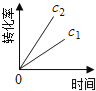
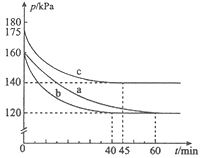
��ͼ����ȷ��ʾ�÷�Ӧ�й��������仯���ɵ��ǣ� ��
��ע��ͼ�а�˥��ָ��һŨ��N2O����һ��ʱ�������Ӧʱ�䣬c1��c2����ʾN2O��ʼŨ����c1��c2��
A�� B��
B��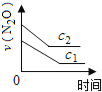 C��
C��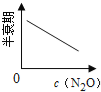 D��
D��