题目内容
【题目】某化学兴趣小组取部分变质的Ca(OH)2(含杂质CaCO3)样品4.0g投入200.0g水中,充分搅拌,通入足量CO2,溶液质量与反应的CO2质量的关系如图所示.则:
(1)以Ca(OH)2全部转化为CaCO3时消耗的CO2质量为_____g;
(2)4.0g样品中杂质CaCO3的质量为______________?(写出计算过程)
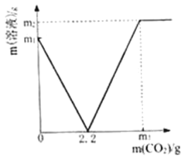
(3)通入m3gCO2时,溶液中生成物的溶质的质量分数为_____(精确到0.1%).若所取样品中的Ca(OH)2没有完全溶于水,对最后的计算结果_____(填“有”、“没有”)影响.原因是_____.
【答案】2.2 0.3g 4.2% 没有 未溶解的氢氧化钙也能与二氧化碳生成碳酸钙.
【解析】
向样品溶液中通入二氧化碳,氢氧化钙与二氧化碳反应生成碳酸钙,溶液质量减少;继续通入二氧化碳,碳酸钙与水、二氧化碳反应生成碳酸氢钙,溶液质量增加。
(1)由图可知,溶液质量为0时,氢氧化钙全部转化为碳酸钙,此时消耗的二氧化碳的质量为2.2g。
(2)设样品中氢氧化钙的质量为x,根据反应方程式Ca(OH)2+CO2=CaCO3+H2O,氢氧化钙与二氧化碳按质量比74:44进行反应,则![]() ,解得x=3.7g,则碳酸钙的质量为4.0g-3.7g=0.3g。
,解得x=3.7g,则碳酸钙的质量为4.0g-3.7g=0.3g。
(3)继续通入二氧化碳,溶液中发生如下反应CaCO3+CO2+H2O=Ca(HCO3)2,设氢氧化钙反应生成的碳酸钙的质量为y,则反应二氧化碳与生成的碳酸钙按质量比为44:100, ![]() ,解得y=5g;设生成碳酸氢钙质量为z,根据反应CaCO3+CO2+H2O=Ca(HCO3)2,反应碳酸钙与生成碳酸氢钙质量比为100:162,则
,解得y=5g;设生成碳酸氢钙质量为z,根据反应CaCO3+CO2+H2O=Ca(HCO3)2,反应碳酸钙与生成碳酸氢钙质量比为100:162,则![]() ,解得z=8.586g,溶质质量分数为
,解得z=8.586g,溶质质量分数为![]() ;若所取样品中的氢氧化钙没有完全溶于水,对最后的计算结果没有影响,因为未溶于水的氢氧化钙固体也能与过量二氧化碳反应生成碳酸钙,故样品最终全部转化为碳酸氢钙。
;若所取样品中的氢氧化钙没有完全溶于水,对最后的计算结果没有影响,因为未溶于水的氢氧化钙固体也能与过量二氧化碳反应生成碳酸钙,故样品最终全部转化为碳酸氢钙。

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | I | II | III | IV | V | VI | VII |
一 | ① | ||||||
二 | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为________________。
(2)④和⑧在周期表中的位置分别是________________;________________。
(3)②和③气态氢化物稳定性的大小顺序:________________(填化学式)。
(4)③⑧⑩的最高价含氧酸的酸性最强的是________________(填化学式)。
(5)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是__(填化学式),属于___(填“共价化合物”或“离子化合物”)。
(6)①④⑩三种元素的原子能形成原子数目比为1∶1∶1的共价化合物,它的电子式为_____。
(7)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是_____(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难
C.比较这两种元素的最高价氧化物对应水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性
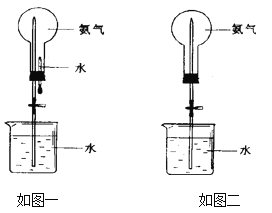
【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
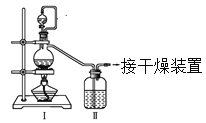
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①________ | ②________ |
制备纯净NO | Cu | ③________ | ④________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
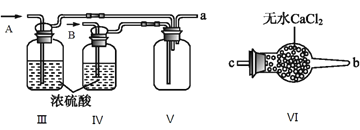
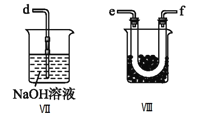
①为了使气体充分反应,从A处进入的气体是____________(填Cl2或NO)。
②装置连接顺序为a→_______________________(按气流自左向右方向,用小写字母表示)。
③装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是________________________。
④装置Ⅷ的烧杯中盛放的试剂是_____________________(填编号①水②冰水③冰盐水)
⑤装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为___________________________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为________________________________。