题目内容
15.硝酸铜是制备Cu-Zn-Al系催化剂的重要原料.现有三种制取硝酸铜的实验方案可供选用:①铜与稀硝酸反应制取:3Cu+8HNO3(稀)$\frac{\underline{\;\;△\;\;}}{\;}$3Cu(NO3)2+2NO↑+4H2O
②铜与浓硝酸反应制取:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
③首先将铜屑在空气中加热生成氧化铜,氧化铜与稀硝酸反应制取:
2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+2HNO3═Cu(NO3)2+H2O
下列说法正确的是( )
| A. | 制取等量的硝酸铜,需硝酸的量②最少 | |
| B. | 制取等量的硝酸铜,②产生的有毒气体比①少 | |
| C. | 三种方案中,硝酸的利用率为③>①>② | |
| D. | 三种方案的反应都可以在铁质容器中进行 |
分析 三种方案中①、②都生成污染性气体,③最经济环保,结合硝酸的性质和方程式解答该题.
解答 解:A.假设制取1mol硝酸铜,由方程式可知①需要$\frac{8}{3}$mol硝酸,②需要4mol硝酸,③需要2mol硝酸,③消耗消耗最少,故A错误;
B.假设制取1mol硝酸铜,由方程式可知①生成$\frac{2}{3}$molNO,②生成2molNO2,则②产生的有毒气体比①多,故B错误;
C.三种方案中,第③方案没有生成污染物,且消耗硝酸最少,故C正确;
D.稀硝酸可与铁反应,不能在铁质容器中进行,故D错误.
故选C.
点评 本题考查硝酸铜的制备实验,为高频考点,注意硝酸的性质及反应方程式中的硝酸的物质的量关系、生成物的性质等,结合原子守恒分析解答,题目难度不大.

练习册系列答案
相关题目
17.下列说法正确的是( )
| A. | 同温同压下,物质的物质的量越大,体积也越大 | |
| B. | 同温同压下,气体的物质的量越大,体积也越大 | |
| C. | 同温同压下,同体积的气体具有相同的原子数 | |
| D. | 体积相同的气体,所含分子数也相同 |
6.按要求回答以下问题:
(1)X、Y、Z 是短周期非金属元素,核电荷数依次增大.X原子外围电子排布为ns2np2,Z是地壳中含量最多的元素.W、Q是第四周期元素,其中Q元素的核电荷数为29.W原子核外未成对电子数在同周期中最多.
①Y元素在周期表中的位置为第二周期VA族;其轨道表示式为 .
.
②X、Y、Z元素的第一电离能由大到小的顺序为N>O>C(用元素符号作答),X与Z形成三原子分子的电子式为 (用相关的化学用语作答).
(用相关的化学用语作答).
③Y的氢化物沸点<Z的氢化物的沸点(填“>”“<”或“=”).
④基态W原子的外围电子排布式为3d54s1.
⑤Q的氢化物的晶胞结构如图1所示,其化学式是CuH.
(2)过渡元素在生活、生产和科技等方面有广泛的用途.
①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,图2为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为1:2.
②现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子.下列说法中不正确的是D.(填序号)
A.PFS中铁显+3价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由上表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
③铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如3-图丙所示.晶胞中铂(Pt)原子的配位数数为为12.

(1)X、Y、Z 是短周期非金属元素,核电荷数依次增大.X原子外围电子排布为ns2np2,Z是地壳中含量最多的元素.W、Q是第四周期元素,其中Q元素的核电荷数为29.W原子核外未成对电子数在同周期中最多.
①Y元素在周期表中的位置为第二周期VA族;其轨道表示式为
 .
.②X、Y、Z元素的第一电离能由大到小的顺序为N>O>C(用元素符号作答),X与Z形成三原子分子的电子式为
 (用相关的化学用语作答).
(用相关的化学用语作答).③Y的氢化物沸点<Z的氢化物的沸点(填“>”“<”或“=”).
④基态W原子的外围电子排布式为3d54s1.
⑤Q的氢化物的晶胞结构如图1所示,其化学式是CuH.
(2)过渡元素在生活、生产和科技等方面有广泛的用途.
①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,图2为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个数比为1:2.
②现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子.下列说法中不正确的是D.(填序号)
| 元素 | Mn | Fe |
| 电离能 | ||
| (kJ•mol-1) | ||
| I1 | 717 | 759 |
| I2 | 1 509 | 1561 |
| I3 | 3 248 | 2 957 |
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由上表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
③铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如3-图丙所示.晶胞中铂(Pt)原子的配位数数为为12.

3.相同质量的下列各烃,完全燃烧后生成CO2最多的是( )
| A. | 甲烷 | B. | 乙烷 | C. | 乙烯 | D. | 苯 |
20.下列化学方程式中不正确的是( )
| A. | CH3CH2CH2OH+HBr$→_{H+}^{△}$CH3CH2CH2Br+H2O | |
| B. | 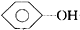 +NaHCO3→ +NaHCO3→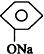 +H2CO3 +H2CO3 | |
| C. | 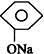 +CO2+H2O→ +CO2+H2O→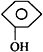 +NaHCO3 +NaHCO3 | |
| D. |  +3Br2→ +3Br2→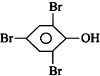 ↓+3HBr ↓+3HBr |
5.下列说法不正确的是( )
| A. | 60周年国庆阅兵车HQE顶级红旗采用全铝车身,铝的氧化物属于两性氧化物 | |
| B. | 用热的纯碱溶液洗涤沾有油污的器具时发生的主要是化学变化 | |
| C. | 英国华裔科学家高锟因在“光在纤维中的传输应用于光学通信方面”做出了突破性成就,而获得了2009年诺贝尔物理学奖,光纤制品的基本原料为SiO2 | |
| D. | 液氨、液氯、液态氯化氢都是非电解质 |
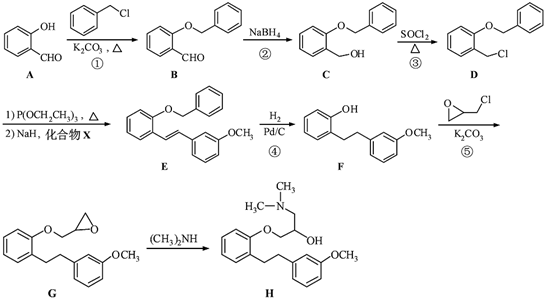
 .
.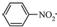 $→_{Pd/C}^{H_{2}}$
$→_{Pd/C}^{H_{2}}$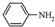 .化合物
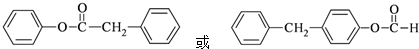
.化合物 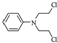 是合成抗癌药物美发伦的中间体,请写出以
是合成抗癌药物美发伦的中间体,请写出以  和
和 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下: