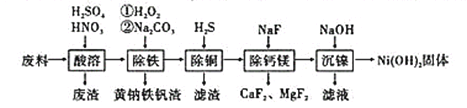
题目内容
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
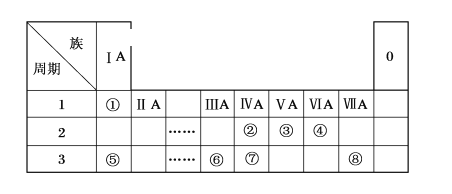
(1)④、⑤、⑥的原子半径由大到小的顺序是_____。(用元素符号表示)
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是____。
(3)③、④、⑥元素可形成含10个电子的微粒,其中A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。用电子式表示下列4种微粒:A_____、B____、C_____、D____。并写出A、B、E三种微粒反应的离子方程式________。
(4)由④⑤⑧三种元素组成的某种盐是家用消毒液的主要成分,将该盐溶液滴入KI淀粉溶液中溶液变为蓝色,则反应的离子方程式为__________。
【答案】Na>Al>O HNO3>H2CO3>H2SiO3 ![]()

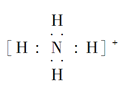
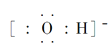 Al3++3NH3+3H2O=Al(OH)3↓+3NH4+ 2I-+ClO-+H2O==I2+Cl-+2OH-
Al3++3NH3+3H2O=Al(OH)3↓+3NH4+ 2I-+ClO-+H2O==I2+Cl-+2OH-
【解析】
根据元素所在周期表中的位置,可知元素的种类,①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为Cl元素。
(1)(1)Na与Al同周期,周期表中,同周期元素从左到右原子半径逐渐减小,则原子半径Na>Al,原子核外电子层数越多,半径越大,则有原子半径Na>Al>O,故答案为:Na>Al>O;
(2)②、③、⑦对应的元素分别为C、N、Si,非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则HNO3>H2CO3>H2SiO3 ,
故答案为:HNO3>H2CO3>H2SiO3 ;
(3)H、N、O、Al元素可形成含10个电子的微粒,其中A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D,则A为H2O、B为NH3、C为NH4+、D为OH-;A、B、E三种微粒反应后可得C和一种白色沉淀,则E为Al3+,A、B、E三种微粒反应的离子方程式为:![]() ,故答案为:
,故答案为:![]()
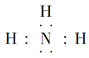
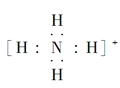
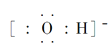 ;
;![]() ;
;
(4))④⑤⑧三种元素组成的某种盐是家用消毒液,则为NaClO,有强氧化性,与KI反应生成I2和KCl,故答案为:![]() 。
。

【题目】硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等。
(1)新制的绿矾(FeSO4·7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:______。
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃。
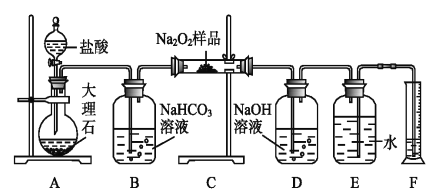
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”。
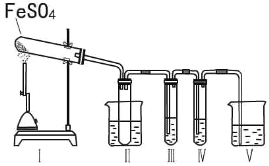
上述装置Ⅲ和Ⅳ用来检验气体产物。试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在___(选填“0℃、25℃、50℃”),装置Ⅱ的作用是___________。
②装置Ⅲ中的试剂可以是________(选填序号,下同),现象是 ,则证明气体产物中含有SO3;装置Ⅳ中的试剂可以是__________________。
A.2mol/LNa2CO3溶液 |
B.品红溶液 |
C.0.5mol/L BaCl2溶液 |
D.0.5mol/LBa(NO3)2 |
E.0.01mol/L KMnO4溶液
F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为_____________。
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
操作步骤 | 预期实验现象 | 预期实验结论 |
向其中一份溶液中加入_______________ | _____________________ | 固体中含有Fe2O3 |
向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | ______________ |
⑤若用22.8g FeSO4固体做实验,完全分解后,得到11.2g固体,其中Fe2O3的质量分数=______(精确到0.1%)