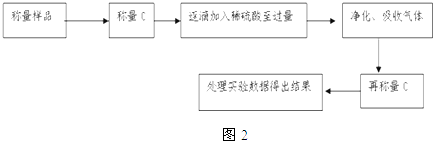
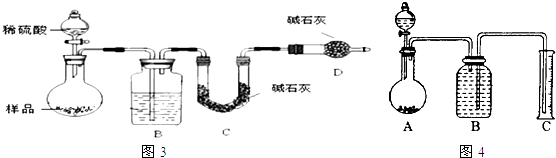
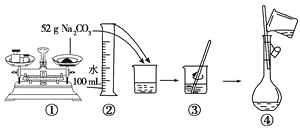
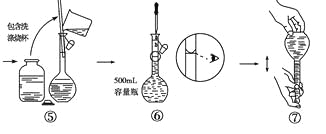
题目内容
【题目】下列叙述不正确的是( )
A.NaOH、Mg(OH)2.、Al(OH)3的碱性逐渐减弱
B.Si、P、S、Cl原子半径逐渐减小
C.C、N、O、F最高正价逐渐减弱
D.K、Na、Mg、Al金属性逐渐减弱
【答案】C
【解析】
A.金属性Na>Mg>Al,最高价氧化物对应水合物的碱性强弱为:NaOH>Mg(OH)2>Al(OH)3,故A正确;
B.同周期元素原子序数越大半径越小,所以Si、P、S、Cl原子半径逐渐减小,故B正确;
C.O、F元素的非金属性较强,无正价,故C错误;
D.同主族元素原子序数越大金属性越强,所以金属性K>Na,同周期元素原子序数越大金属性越弱,所以金属性Na>Mg>Al,故D正确;
故答案为C。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】钠及其化合物具有广泛的用途.
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合氢离子能力最强的是;根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是(填序号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:①②(填“>”“=”“<”下同);溶液中阴离子的物质的量浓度之和:①②.
(3)实验室中常用氢氧化钠来进行洗气和提纯. ①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有.
②几种离子开始沉淀时的pH如表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时,(填离子符号)先沉淀,Ksp[Fe(OH)3]Ksp[Mg(OH)2](填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 . ( Ksp[Cu(OH)2]=2×10﹣20 )