题目内容
【题目】某校课外小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验.
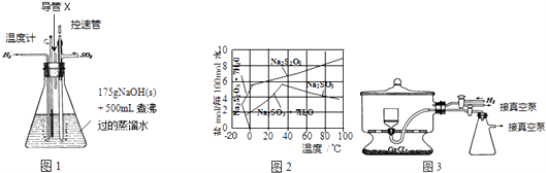
方案Ⅰ.甲组同学用质量法,按如图1所示的实验流程进行实验:
(1)实验时,蒸发结晶操作中,除了酒精灯外,还要用到的仪器是
(2)有同学认为“加入适量盐酸”不好操控,应改为“过量盐酸”,便于操作且不影响测定的准确性,你认为对或错 , 为什么 .
(3)若实验中测得样品质量为46.4g,固体质量为40.95g,则碳酸钠的质量分数为 . (保留3位有效数字)
(4)蒸发结晶过程中若有固体飞溅,测得碳酸钠的质量分数(填偏大 偏小 无影响).
(5)方案Ⅱ:乙组同学的主要实验流程图如图2:
按如图3所示装置进行实验:
在C中装碱石灰来吸收净化后的气体.D装置的作用是 .
(6)有的同学认为为了减少实验误差,在反应前后都通入N2 , 反应后通入N2的目的是 .
(7)方案Ⅲ:气体分析法
把一定量样品与足量稀硫酸反应后,用如图4装置测量产生CO2气体的体积,B溶液最好采用(以下选项中选择)使测量误差较小.
a.饱和碳酸钠溶液 b.饱和碳酸氢钠溶液
c.饱和氢氧化钠溶液 d.饱和硫酸铜溶液.
【答案】
(1)蒸发皿、玻璃棒
(2)对;因盐酸易挥发,过量的盐酸在加热过程中挥发不残留,不影响结果
(3)45.7%
(4)
偏小
(5)吸收空气中的水蒸气和二氧化碳,以确保前一个干燥管中质量增加量的准确性
(6)将B、C装置中残留CO2全部驱入D装置的碱石灰中,减小实验误差
(7)b
【解析】解:(1.)蒸发结晶操作中,需要蒸发皿、酒精灯、玻璃棒等,所以答案是:蒸发皿、玻璃棒;
(2.)利用的是样品质量和反应后所得氯化钠的质量计算,过滤盐酸再蒸发浓缩时挥发,对测定结果无影响,改为“过量盐酸”,便于操作且不影响测定的准确性,因盐酸易挥发,过量的盐酸在加热过程中挥发不残留,不影响结果;
所以答案是:因盐酸易挥发,过量的盐酸在加热过程中挥发不残留,不影响结果;
(3.)若实验中测得样品质量为46.4g,固体质量为40.95g,设碳酸钠物质的量为x,碳酸氢钠物质的量为Y,
106x+84y=46.4
2x+y= ![]()
x=0.2mol
y=0.3mol
碳酸钠的质量分数为 ![]() ×100%=45.7%,
×100%=45.7%,
所以答案是:45.7%;
(4.)蒸发结晶过程中若有固体飞溅,氯化钠质量减少,测定碳酸钠质量分数减小,所以答案是:偏小;
(5.)空气中的水蒸气和二氧化碳会被碱石灰吸收,故D的作用是吸收空气中的水蒸气和二氧化碳,以确保前一个干燥管中质量增加量的准确性;
所以答案是:吸收空气中的水蒸气和二氧化碳,以确保前一个干燥管中质量增加量的准确性;(6.)该方案关键是要获得产生的CO2的质量,实验前容器内含有空气,空气中含有二氧化碳,会影响生成的二氧化碳的量,反应后装置中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差,所以反应前后都要通入N2 , 反应后通入N2的目的是:将生成的二氧化碳从容器内排出,被C装置中碱石灰吸收.
所以答案是:将B、C装置中残留CO2全部驱入D装置的碱石灰中,减小实验误差.
方案Ⅲ:气体分析法
(7.)利用测定反应生成的二氧化碳气体体积的方法测定,在碳酸氢钠溶液中二氧化碳不反应,溶解度减小,利用装置图排饱和碳酸氢钠溶液测定二氧化碳气体的体积,二氧化碳和碳酸钠、氢氧化钠都反应,在硫酸铜溶液中也溶解,
所以答案是:b.