题目内容
水煤气转化反应CO(g)+H2O(g)  CO2(g)+H2 (g)在一定温度下达到化学平衡状态。
CO2(g)+H2 (g)在一定温度下达到化学平衡状态。
完成下列填空:
(1)写出该反应的平衡常数表达式K=________________。
(2)一定温度下,在一个容积不变的密闭容器中发生上述反应,下列说法中能判断该反应达到化学平衡状态的是 (选填编号)。
a.容器中的压强不变 b.1 mol H-H键断裂的同时断裂2 molH-O键
c.v正(CO) = v逆(H2O) d.c(CO) = c(H2)
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下实验组1和实验组2的数据:
①由实验组1的数据可知,平衡时CO的转化率为 %。
②由实验组1和2的数据可分析,压强对该可逆反应的影响是 。
③有了实验组1和2的数据,再设计实验组3,其目的是 。
 CO2(g)+H2 (g)在一定温度下达到化学平衡状态。
CO2(g)+H2 (g)在一定温度下达到化学平衡状态。完成下列填空:
(1)写出该反应的平衡常数表达式K=________________。
(2)一定温度下,在一个容积不变的密闭容器中发生上述反应,下列说法中能判断该反应达到化学平衡状态的是 (选填编号)。
a.容器中的压强不变 b.1 mol H-H键断裂的同时断裂2 molH-O键
c.v正(CO) = v逆(H2O) d.c(CO) = c(H2)
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下实验组1和实验组2的数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 3 |
| 2 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 3 | 950 | 1 | 2 | — | — | — |
①由实验组1的数据可知,平衡时CO的转化率为 %。
②由实验组1和2的数据可分析,压强对该可逆反应的影响是 。
③有了实验组1和2的数据,再设计实验组3,其目的是 。
(1) (1分)
(1分)
(2) b、c (2分)
(3)①40%(1分)。
②增大压强加快反应速率;增大压强化学平衡不移动(或反应物的转化率不变。合理即可)(2分)。
③温度对化学反应速率的影响;该反应是吸热还是放热反应(温度对化学平衡移动的影响)(2分)
 (1分)
(1分)(2) b、c (2分)
(3)①40%(1分)。
②增大压强加快反应速率;增大压强化学平衡不移动(或反应物的转化率不变。合理即可)(2分)。
③温度对化学反应速率的影响;该反应是吸热还是放热反应(温度对化学平衡移动的影响)(2分)
试题分析:(1)可逆反应CO(g)+H2O(g)?CO2(g)+H2 (g)的化学平衡常数k=
 ;
;(2)a.反应前后气体的物质的量不发生变化,容器中始终压强不变,不能说明反应到达平衡,故A错误; b.l molH-H键断裂的同时断裂2mol H-O键,断裂2mol H-O键同时生成l molH-H键,说明反应到达平衡,故B正确; c.根据反应可知,自始至终v正(CO)=v正(H2O),若v正(CO)=v逆(H2O),则v正(H2O)=v逆(H2O),说明反应到达平衡,故C正确; d.根据反应可知,自始至终c(CO)=c(H2),不能说明反应到达平衡,故D错误;故选:bc;
(3)①、由表中数据可知,实验1组3min到达平衡,平衡时CO的物质的量变化量为4mol-2.4mol=1.6mol,故CO的转化率为1.6/4×100%=40%,故答案为:40;
②、由表中数据可知,实验1组压强为实验2组的2倍,实验1组压强增大到达平衡时缩短,故增大压强反应速率加快,平衡时各组分的物质的量为实验2组的2倍,增大压强反应物转化率不变,化学平衡不移动,故答案为:增大压强反应速率加快;增大压强反应物转化率不变,化学平衡不移动;
③、根据控制变量法分析,实验3与实验1、2组相比温度升高,压强对平衡不影响,故应是探究温度对该反应平衡的影响,对反应速率的影响,
故答案为:探究温度对该反应平衡的影响,对反应速率的影响.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq) PCl3(g)+Cl2(g) △H=+Q KJ/mol维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是( )
PCl3(g)+Cl2(g) △H=+Q KJ/mol维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是( )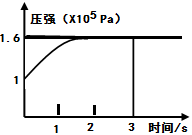
 2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):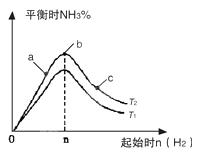
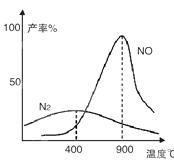
 4NO+6H2O ,4NH3+3O2
4NO+6H2O ,4NH3+3O2 CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是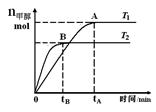
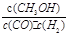
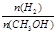 增大
增大 3Z(g)。Z的含量(Z%)随时间t的变化如下图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是
3Z(g)。Z的含量(Z%)随时间t的变化如下图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是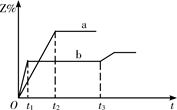
 N2(g)+2CO2(g) △H=-373.4kJ/mol
N2(g)+2CO2(g) △H=-373.4kJ/mol
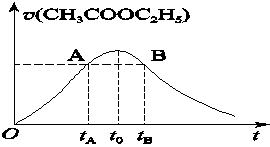
 CH3COOH+C2H5OH已知该反应的速率随c(H+)的增大而加快。图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是( )
CH3COOH+C2H5OH已知该反应的速率随c(H+)的增大而加快。图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是( )