题目内容
【题目】一定条件下,向容器的体积为4L的密闭容器中通入1mol N2和3mol H2,发生反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,达到平衡后。试回答下列问题:
2NH3(g)△H<0,达到平衡后。试回答下列问题:
(1)该条件下,反应的平衡常数表达式K=____________。 达到平衡后,若其它条不变,升高体系的温度,平衡常数K将 (填“增大”、“减小”或“不变”)。
(2)达到平衡后,在恒容条件下,向容器中通入氦气(He),氮气的转化率将_______(“增大”、“减小”或“不变”,下同)。 若再通入1mol N2和3mol H2,氮气的转化率将 。
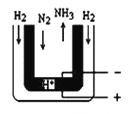
(3)常压下,把H2和用氦气(He)稀释的N2分别通入一个加热到570℃的电解池装置,H2和N2便可在电极上合成氨,装置中所用的电解质(图中黑细点)能传导H+,则阴极的电极反应式为
(4)三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数随时间变化如图。下列说法正确的是 ;
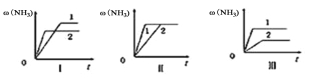
a.图Ⅰ可能是不同温度对反应的影响,且T2>T1
b.图Ⅲ可能是不同压强对反应的影响,且p1>p2
c.图Ⅱ可能是同温同压下,催化剂性能,1>2
【答案】(1)c2(NH3)/c(N2)·c3(H2) 减小
(2)不变,增大
(3)N2+6e-+6H+=2NH3
(4)abc
【解析】
试题分析:(2)N2(g)+3H2(g)![]() 2NH3(g)的平衡常数表达式K=
2NH3(g)的平衡常数表达式K=![]() ,正反应为放热反应,升高体系温度平衡逆向移动,平衡常数减小;
,正反应为放热反应,升高体系温度平衡逆向移动,平衡常数减小;
(2)达到平衡后,在恒容条件下,向容器中通入氦气(He),压强增大,但浓度不变,平衡不移动,氮气的转化率将不变, 若再通入1mol N2和3mol H2,平衡正向移动,氮气的转化率将增大;
(3)阴极发生还原反应,氮气在阴极获得电子,与电解质传导的H+结合生成氨气,阴极电极反应式为:N2+6e-+6H+=2NH3;
(4)a.升高温度反应速率加快,到达平衡时间缩短,故温度T2>T1,正反应为放热反反应,升高温度平衡逆向移动,氨气体积分数应减小,图象与实际相符,故a正确;b.增大压强反应速率加快,故压强p2>p1,但平衡正向移动,氨气体积分数增大,图象与实际相符,故b正确;c.催化剂不影响平衡移动,由图象可知1到达平衡时间过短,故催化剂性能1>2,故c正确;故选abc。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁(已知其中有一种中间产物是MgCO3)。

若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
表2原料价格表
物质 | 价格/元吨-1 |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。
(1)在步骤②中加入的试剂X,最佳的选择是______,其反应的离子方程式是 。
(2)在步骤③中如要控制pH=9.8,其目的是______;在步骤④中加入的试剂Y应是______;
(3)在步骤⑤中发生的化学方程式是______。