题目内容
【题目】下图Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ是常见的气体制备,净化,收集装置,根据要求回答下列问题:
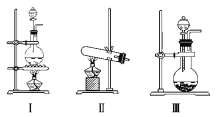
(1)若用MnO2与浓盐酸反应制取氯气,应选用发生装置_______,用化学方程式表示制取氯气的反应原理是______________________。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用发生装置__________,试完成并配平下列离子方程式:_____MnO4- + ____Cl- + ____H+ === ____Mn2+ + ____Cl2↑ + ____。
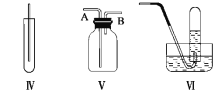
(3)若选用MnO2与浓盐酸反应制取的氯气含有杂质气体。可以选择 装置来除杂,装置中盛放的溶液依次为 和 。
(4)若选用Ⅳ为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用________溶液浸湿,其作用是_______________________。
(5)若选用Ⅴ为氯气收集装置,则氯气应从__________口通入。用化学方法检验氯气收集满了的方法是_____________________
(6)氯气有毒,可选择通过 溶液来处理尾气。发生的离子方程式为 。
【答案】(1)Ⅰ;MnO2+4HC1(浓)![]() MnC12+C12↑+2H2O;
MnC12+C12↑+2H2O;
(2)Ⅲ;2;10;16;2;5;8H2O;
(3) Ⅴ;饱和食盐水;浓硫酸;
(4)氢氧化钠;防止氯气逸出污染空气;
(5)A;将湿润的淀粉KI试纸放在B口处,试纸变蓝色,证明氯气已集满
(6)NaOH;Cl2+2OH-=Cl-+ClO-+H2O
【解析】
试题分析:(1)二氧化锰和浓盐酸的反应是固液混合加热型,所以选择Ⅰ装置;在加热条件下,二氧化锰和浓盐酸反应生成氯化锰、氯气和水,MnO2+4HC1(浓)![]() MnC12+C12↑+2H2O,故答案为:Ⅰ;MnO2+4HC1(浓)
MnC12+C12↑+2H2O,故答案为:Ⅰ;MnO2+4HC1(浓)![]() MnC12+C12↑+2H2O;
MnC12+C12↑+2H2O;
(2)KMnO4与浓盐酸的反应是固液混合不需要加热的,所以应选择Ⅲ装置;MnO4-中锰元素的化合价是+7价,Mn2+的化合价是+2价,所以一个MnO4-生成Mn2+得5个电子,生成一个C12分子需要2个氯离子失去2个电子,所以得失电子的最小公倍数是10,再根据元素守恒知,生成物中还有水;所以该离子方程式中的计量数分别为:2、10、16、2、5、8,故答案为:Ⅲ;2;10;16;2;5;8H2O;
(3)若选用MnO2与浓盐酸反应制取的氯气,由于浓盐酸检验挥发性,制得的气体中含有杂质气体氯化氢和水蒸气。可以选择Ⅴ装置来除杂,除杂时先用饱和食盐水除去氯化氢,再用浓硫酸除去水蒸气,故答案为:Ⅴ;饱和食盐水;浓硫酸;
(4)氯气有毒,逸出会污染大气,所以不能让氯气逸出;氯气和水能反应是盐酸和次氯酸,盐酸和次氯酸是酸,都能和碱反应,所以可用氢氧化钠溶液吸收氯气,故答案为:氢氧化钠;防止氯气逸出污染空气;
(5)氯气的密度大于空气的密度,所以应采用向上排空气法收集氯气,故A为进气口;氯气的氧化性大于碘的氧化性,所以氯气能置换出碘化钾中的碘,且碘遇淀粉变蓝色,所以可用湿润的淀粉KI试纸检验是否收集满了氯气,故答案为:A;将湿润的淀粉KI试纸放在B口处,试纸变蓝色,证明氯气已集满
(6)氯气有毒,可选择通过氢氧化钠溶液来处理尾气。发生的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:NaOH;Cl2+2OH-=Cl-+ClO-+H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案