题目内容
【题目】将CoCl2溶解于盐酸中可以形成CoCl42-,在溶液中存在下面的化学平衡:
Co2+(aq)+4Cl-(aq) ![]() CoCl42-(aq) ΔH>0
CoCl42-(aq) ΔH>0
粉红色 蓝色
下列说法正确的是
A. 升高温度,正反应速率增大,逆反应速率减小
B. 该反应的平衡常数K=c(CoCl42-)/[c(Co2+)c4(Cl-)]
C. 将盛有CoCl2和盐酸混合液的试管置于热水中,试管内溶液为红色
D. 增大Cl-浓度,平衡向正反应方向移动,Co2+、Cl-浓度都减小
【答案】B
【解析】
A、升高温度,正、逆反应速率都增大;
B、化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
C、Co2+为红色,CoCl42-是蓝色,该反应正反应是吸热反应,升高温度平衡向正反应移动;
D、增大Cl-浓度,平衡正向移动,Co2+浓度减小,但Cl-浓度增大。
A项、升高温度,正、逆反应速率都增大,但正反应速率增大更多,故A错误;
B项、Co2+(aq)+4Cl-(aq)CoCl42-(aq)的化学平衡常数k= c(CoCl42-)/[c(Co2+)c4(Cl-)],B正确;
C项、Co2+为红色,CoCl42-是蓝色,该反应正反应是吸热反应,升高温度平衡向正反应移动,溶液呈蓝色,故C错误;
D项、增大Cl-浓度,平衡正向移动,Co2+浓度减小,CoCl42-增大,因化学平衡常数不变,溶液中Cl-浓度增大,故D错误。
故选B。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】苯甲酸是常用的防腐剂和重要的医药原料。一种药用苯甲酸的制备方法如下:
Ⅰ.在反应罐中加入甲苯、饱和KMnO4溶液、Fe2O3(催化剂),加热、回流数小时,充分反应。
Ⅱ.反应结束后,改为蒸馏装置。加热蒸馏,直至冷凝管壁不再出现油珠。
Ⅲ.将反应罐中的混合物趁热过滤,滤渣用少量热水洗涤。
Ⅳ.向滤液中滴加浓盐酸酸化至pH=2,抽滤,用少量水洗涤,干燥得苯甲酸粗品。
Ⅴ.将粗苯甲酸加入……,结晶、洗涤、过滤,得到药用纯苯甲酸。
已知:相关物质的溶解度(g/mL)
温度(℃) | 25 | 50 | 60 | |
苯甲酸 | 在水中 | 0.0034 | 0.0085 | 0.0095 |
在乙醇中 | 0.4 | 0.7 | 1 | |
氯化钾 | 在乙醇中 | 难溶 | ||
(1)Ⅰ中发生的主要反应为:![]() (未配平),则Ⅳ中发生反应的离子方程式为______。
(未配平),则Ⅳ中发生反应的离子方程式为______。
(2)Ⅱ中蒸馏的目的是______。
(3)Ⅲ中趁热过滤的目的是______。
(4)将Ⅴ中操作补充完整:______。
【题目】某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下:
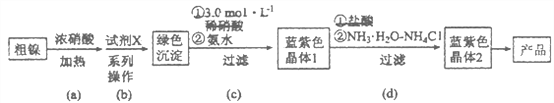
已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1 mol·L-1计算)如下表所示:
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
回答下列问题:
(1)实验需要配制3.0mol·L-1稀硝酸250mL,需要的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和_________________。
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为________________。
(3)步骤(b)首先加入试 剂X调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是_______________________________________________。
②试剂X可以是__________________(填标号)。
A. H2SO4 B. Ni(OH)2 C. NaOH D. Fe2O3 E. NiO
(4)NH3含量的测定
i. 用电子天平称量mg产品于锥形瓶中,用25mL水溶解后加入3.00mL 6 mol/L盐酸,以甲基橙作指示剂,滴定至终点消耗0.500 0 mol·L-1NaOH标准溶液V1mL;
ii. 空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
NH3的质量分数为____________。(用V1 ,V2表示)
②在上述方案的基础上,下列措施能进一步提高测定准确度的有____________(填标号)。
A. 适当提高称量产品的质量 B. 用H2SO4溶液替代盐酸
C. 用酚酞替代甲基橙 D. 进行平行实验
(5)为测定Cl-的含量,请补充完整下述实验方案。
称量mg产品于锥形瓶中,用25mL水溶解,________________,滴入2~3滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作2~3次。
【题目】用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g) = 2NO(g)△H=+180.5kJ/mol,N2(g)+3H2(g) ![]() 2NH3(g)△H=-92.4kJ/mol,2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol,写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为_________。
2NH3(g)△H=-92.4kJ/mol,2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol,写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为_________。
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。
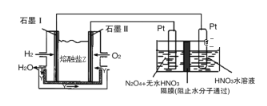
写出石墨I电极上发生反应的电极反应式_______________________________,在电解池中生成N2O5的电极反应式为__________________________________。
(3)以甲醇燃料电池为电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为________L。
(4)在一定体积的密闭容器中,进行如下化学反应: N2(g)+3H2(g) ![]()
![]() 2NH3(g),其化学平衡常数K与温度t的关系如下表:
2NH3(g),其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | … |
K/(mol·L-1)2 | 4.1106 | K1 | K2 | … |
完成下列问题:
①已知该反应能够自发进行,试比较K1、K2的大小:K1_______ K2(填“>”、“=”或“<”);
②在同温同压时判断该反应达到化学平衡状态的依据是_________(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(5)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式__________________________________;
②盐酸肼水溶液中离子浓度的排列顺序不正确的是__________(填序号)。
A.c(Cl-)>c(N2H62+)> c(OH-)> c(H+)
B.c(Cl-)>c([N2H5·H2O]+)> c(H+)>c(OH-)
C.2 c(N2H62+)+ c([N2H5·H2O]+)+c(H+)= c(Cl-)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)