题目内容
aX、bY、cZ、dW为四种短周期主族元素,其中d-c=c-b=b-a=2.下列说法中不正确的是( )
分析:aX、bY、cZ、dW为四种短周期主族元素,其中d-c=c-b=b-a=2,说明这四种元素原子序数a到d依次增大2,
A.在第二、三周期元素中,短周期主族元素原子序数可能依次相差2;
B.若X是N元素,其最高价氧化物的水化物是强酸;
C.元素的最外层电子数不超过8个,所以W是第二周期元素,W的原子最外层电子数为电子层数的3倍,则W是O元素,X为He元素;
D.X和W两种元素的原子序数相差6,如果X是H元素,则W是N元素,氨气是碱性气体.
A.在第二、三周期元素中,短周期主族元素原子序数可能依次相差2;
B.若X是N元素,其最高价氧化物的水化物是强酸;
C.元素的最外层电子数不超过8个,所以W是第二周期元素,W的原子最外层电子数为电子层数的3倍,则W是O元素,X为He元素;
D.X和W两种元素的原子序数相差6,如果X是H元素,则W是N元素,氨气是碱性气体.
解答:解:aX、bY、cZ、dW为四种短周期主族元素,其中d-c=c-b=b-a=2,说明这四种元素原子序数a到d依次增大2,
A.X和W的原子序数相差6,在第二、三周期元素中,第IA族和第VIIA族元素原子序数相差6,故A正确;
B.若X是N元素,其最高价氧化物的水化物是硝酸,硝酸是强酸,故B正确;
C.元素的最外层电子数不超过8个,所以W是第二周期元素,W的原子最外层电子数为电子层数的3倍,则W是O元素,X为He元素,氦为0族元素,故C错误;
D.X和W两种元素的原子序数相差6,如果X是H元素,则W是N元素,二者形成的化合物是氨气,氨气溶于水生成一水合氨,一水合氨电离出氢氧根离子而使溶液呈碱性,故D正确;
故选C.
A.X和W的原子序数相差6,在第二、三周期元素中,第IA族和第VIIA族元素原子序数相差6,故A正确;
B.若X是N元素,其最高价氧化物的水化物是硝酸,硝酸是强酸,故B正确;
C.元素的最外层电子数不超过8个,所以W是第二周期元素,W的原子最外层电子数为电子层数的3倍,则W是O元素,X为He元素,氦为0族元素,故C错误;
D.X和W两种元素的原子序数相差6,如果X是H元素,则W是N元素,二者形成的化合物是氨气,氨气溶于水生成一水合氨,一水合氨电离出氢氧根离子而使溶液呈碱性,故D正确;
故选C.
点评:本题考查了原子结构和元素周期律的关系,明确元素在周期表中的位置及其性质是解本题关键,采用假设的方法进行解答,难度中等.

练习册系列答案
相关题目
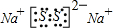
 cZ(g)+dW(g),5 min后达到平衡,X减少n mol·L-1,Y减少
cZ(g)+dW(g),5 min后达到平衡,X减少n mol·L-1,Y减少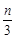 mol·L-1,Z增加
mol·L-1,Z增加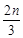 mol·L-1。在其他条件不变时,将容器体积增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为
mol·L-1。在其他条件不变时,将容器体积增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为