题目内容
在一定条件下,在密闭容器中进行的反应
aX(g)+bY(g)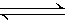 cZ(g)+dW(g),5 min后达到平衡,X减少n mol·L-1,Y减少
cZ(g)+dW(g),5 min后达到平衡,X减少n mol·L-1,Y减少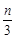 mol·L-1,Z增加
mol·L-1,Z增加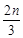 mol·L-1。在其他条件不变时,将容器体积增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为
mol·L-1。在其他条件不变时,将容器体积增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为
A.1∶3∶1∶2 B.3∶1∶2∶2 C.3∶1∶2∶1 D.1∶3∶2∶2
【答案】
B
【解析】
试题分析:平衡时X减少n mol·L-1,Y减少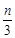 mol·L-1,Z增加
mol·L-1,Z增加 mol·L-1,所以根据变化量之比是相应的化学计量数之比可知,a︰b︰c=3∶1∶2。又因为将容器体积增大,W的百分含量不发生变化,这说明反应前后气体的体积是不变的,因此d=2,即选项B正确,答案选B。
mol·L-1,所以根据变化量之比是相应的化学计量数之比可知,a︰b︰c=3∶1∶2。又因为将容器体积增大,W的百分含量不发生变化,这说明反应前后气体的体积是不变的,因此d=2,即选项B正确,答案选B。
考点:考查反应速率与化学计量数的关系
点评:本题是基础性试题的考查,主要是考查学生灵活运用知识的能力,有利于巩固学生的基础知识,提高学习效率和答题能力。

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
在一定条件下,在密闭容器中进行可逆反应:A(g)+B(g)?C(g)+D(g),能说明该反应达到化学平衡状态的是( )
| A、正反应和逆反应的速率相等 | B、正反应速率逐渐减小,最后为零 | C、反应停止,A、B、C、D的浓度相等 | D、A、B、C、D四种物质在密闭容器中共存 |
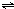 ClO(g)+3H2(g)△H>0.
ClO(g)+3H2(g)△H>0.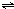 CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
 C (g) + D(g),能说明该反应达到化学平衡状态的是
C (g) + D(g),能说明该反应达到化学平衡状态的是