题目内容
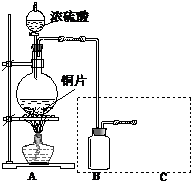
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究氯气与碳酸钠反应得到的固体物质。

⑴写出装置A中发生反应的化学方程式:
⑵写 出试剂Y的名称:
出试剂Y的名称:
⑶已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有碳酸氢钠,现对C成分进行猜想和探究。①提出合理假设。
假设1:存在两种成分:Na HCO3和 ;
假设2:存在三种成分:Na HCO3和 、 ;
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。限选实验试剂和仪器:蒸馏水、稀硝酸、氯化钡溶液、澄清石灰水、硝酸银溶液、试管、小烧杯
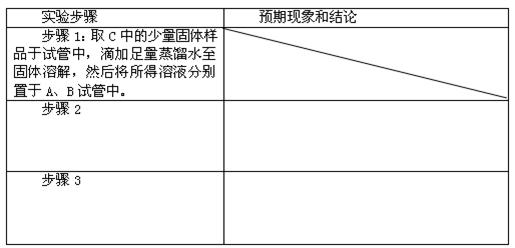
⑷根据上述实验现象,有同学得出“干燥的氯气能和碳酸钠固体反应”的结论。该结论严密吗?为什么?
⑸若C中有0.1molCl 2恰好与装置中Na 2CO3完全反应,且假设1成立,可推知C中反应的化学方程式为:

⑴写出装置A中发生反应的化学方程式:
⑵写
 出试剂Y的名称:
出试剂Y的名称: ⑶已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有碳酸氢钠,现对C成分进行猜想和探究。①提出合理假设。
假设1:存在两种成分:Na HCO3和 ;
假设2:存在三种成分:Na HCO3和 、 ;
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。限选实验试剂和仪器:蒸馏水、稀硝酸、氯化钡溶液、澄清石灰水、硝酸银溶液、试管、小烧杯

⑷根据上述实验现象,有同学得出“干燥的氯气能和碳酸钠固体反应”的结论。该结论严密吗?为什么?
⑸若C中有0.1molCl 2恰好与装置中Na 2CO3完全反应,且假设1成立,可推知C中反应的化学方程式为:
(1)实验室制备氯气的化学方程式(2分 不写加热为0分)
(2)饱和的氯化钠(2分)
(3)氯化钠 氯化钠和碳酸钠 (每空1分,共3分)
步骤2:在A中加入氯化钡溶液 若有沉淀生成,说明有碳酸钠;若没有沉淀说明没有碳酸钠 在B中加入稀硝酸酸化硝酸银溶液 若有白色沉淀说明有氯化钠,若无沉淀就没有氯化钠(每行3分 共6分)
(4)不严密(1分),因为有碳酸氢钠生成,氢元素就应来源于水,故是潮湿的氯气与碳酸钠反应(2分)
(5)2 Cl2+2Na 2CO3 +H2O=2NaHCO3+2NaCl+Cl2O(2分)
(2)饱和的氯化钠(2分)
(3)氯化钠 氯化钠和碳酸钠 (每空1分,共3分)
步骤2:在A中加入氯化钡溶液 若有沉淀生成,说明有碳酸钠;若没有沉淀说明没有碳酸钠 在B中加入稀硝酸酸化硝酸银溶液 若有白色沉淀说明有氯化钠,若无沉淀就没有氯化钠(每行3分 共6分)
(4)不严密(1分),因为有碳酸氢钠生成,氢元素就应来源于水,故是潮湿的氯气与碳酸钠反应(2分)
(5)2 Cl2+2Na 2CO3 +H2O=2NaHCO3+2NaCl+Cl2O(2分)
略

练习册系列答案
相关题目
 除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验:
除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验:
 -二氯乙烷已发生消去反应的现象是_______________,还可通过什
-二氯乙烷已发生消去反应的现象是_______________,还可通过什 么实验加以验证:________________________________________。
么实验加以验证:________________________________________。 Cu(OH)2均不带结晶水;
Cu(OH)2均不带结晶水;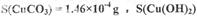
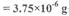 ;若由此数据判断,假设_______是不正确的。
;若由此数据判断,假设_______是不正确的。

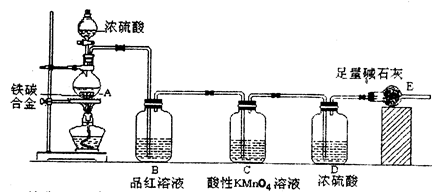
 组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低的是(任答一条即可)
组内有同学提出,本套装置在设计上存在多处缺陷而导致实验结果不准确,其中会导致铁质量分数测量值偏低的是(任答一条即可)