题目内容
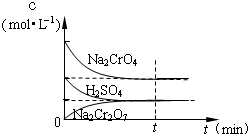 在25℃时,向Na2CrO4溶液中滴加稀硫酸,溶液由黄色转变为橙色,在此转化过程中,各物质浓度变化如图所示.写出转化过程中发生反应的离子方程式
在25℃时,向Na2CrO4溶液中滴加稀硫酸,溶液由黄色转变为橙色,在此转化过程中,各物质浓度变化如图所示.写出转化过程中发生反应的离子方程式2 CrO42-+2 H+?Cr2O72-+H2O
2 CrO42-+2 H+?Cr2O72-+H2O
.已知:Ag2CrO4为砖红色沉淀,Ag2CrO4KSP为9.0×10-12.以2~3滴Na2CrO4溶液为指示剂,用AgNO3溶液滴定含Cl-的溶液,可测定溶液中的c(Cl-).滴定过程中首先析出沉淀为AgCl,达到滴定终点的实验现象是
加入最后一滴AgNO3溶液出现砖红色沉淀
加入最后一滴AgNO3溶液出现砖红色沉淀
.(1)在滴定过程中要控制Na2CrO4的浓度和溶液的pH值,其pH范围应在6.5~10.5,若pH<6.5实验结果偏高.请用平衡移动原理分析为什么结果会偏高?
由于存在2 CrO42-+2 H+?Cr2O72-+H2O,若小于6.5则该平衡向右移动c(CrO42-)减小,根据Ag2CrO4的KSP可知c(CrO42-)减小,则需要的c(Ag+)增大,则测定结果增大
由于存在2 CrO42-+2 H+?Cr2O72-+H2O,若小于6.5则该平衡向右移动c(CrO42-)减小,根据Ag2CrO4的KSP可知c(CrO42-)减小,则需要的c(Ag+)增大,则测定结果增大
.(2)实验过程中应该用酸式滴定管盛AgNO3溶液,盛AgNO3溶液前洗涤酸式滴定管的正确操作是:用水洗净酸式滴定管后,从滴定管上口加入3~5mLAgNO3溶液,
倾斜着转动滴定管,使液体润湿全部滴定管内壁,然后,一手控制活塞,将液体从滴定管下部放入预置的烧杯中,重复该操作1~2次即可
倾斜着转动滴定管,使液体润湿全部滴定管内壁,然后,一手控制活塞,将液体从滴定管下部放入预置的烧杯中,重复该操作1~2次即可
(请补充完整).分析:铬酸根离子在酸性环境下可以变成重铬酸根离子;K2CrO4为指示剂,Ag2CrO4为砖红色,用标准硝酸银滴定待测液,滴定终点的现象是滴入最后一滴标准溶液,生成砖红色沉淀;
(1)由于存在2 CrO42-+2 H+?Cr2O72-+H2O,若小于6.5,氢离子浓度较大,则该平衡向右移动c(CrO42-)减小,形成沉淀时消耗的c(Ag+)偏大;
(2)洗涤酸式滴定管的操作是:用水洗净酸式滴定管后,待装溶液洗.
(1)由于存在2 CrO42-+2 H+?Cr2O72-+H2O,若小于6.5,氢离子浓度较大,则该平衡向右移动c(CrO42-)减小,形成沉淀时消耗的c(Ag+)偏大;
(2)洗涤酸式滴定管的操作是:用水洗净酸式滴定管后,待装溶液洗.
解答:解:根据图中的转化关系⑤,可知铬酸根在酸性环境下可以变成重铬酸根,黄色溶液逐渐变成橙色,实质是:2CrO42-+2H+ Cr2O72-+H2O;滴定过程中首先析出沉淀为AgCl,当氯离子完全沉淀以后,开始生成Ag2CrO4砖红色沉淀,则滴入最后一滴硝酸银溶液时,溶液中出现砖红色深沉;
Cr2O72-+H2O;滴定过程中首先析出沉淀为AgCl,当氯离子完全沉淀以后,开始生成Ag2CrO4砖红色沉淀,则滴入最后一滴硝酸银溶液时,溶液中出现砖红色深沉;
故答案为:2CrO42-+2H+ Cr2O72-+H2O;加入最后一滴AgNO3溶液出现砖红色沉淀;
Cr2O72-+H2O;加入最后一滴AgNO3溶液出现砖红色沉淀;
(1)由于存在2 CrO42-+2 H+?Cr2O72-+H2O,若小于6.5,氢离子浓度较大,则该平衡向右移动,c(CrO42-)减小,根据Ag2CrO4的KSP可知c(CrO42-)减小,则需要的c(Ag+)增大,则测定结果增大;
故答案为:由于存在2 CrO42-+2 H+?Cr2O72-+H2O,若小于6.5则该平衡向右移动c(CrO42-)减小,根据Ag2CrO4的KSP可知c(CrO42-)减小,则需要的c(Ag+)增大,则测定结果增大;
(2)洗涤酸式滴定管的操作是:用水洗净酸式滴定管后,再用待装溶液洗,所以其操作为:用水洗净酸式滴定管后,从滴定管上口加入3~5mLAgNO3溶液,倾斜着转动滴定管,使液体润湿全部滴定管内壁,然后,一手控制活塞,将液体从滴定管下部放入预置的烧杯中,重复该操作1~2次即可;
故答案为:倾斜着转动滴定管,使液体润湿全部滴定管内壁,然后,一手控制活塞,将液体从滴定管下部放入预置的烧杯中,重复该操作1~2次即可;
 Cr2O72-+H2O;滴定过程中首先析出沉淀为AgCl,当氯离子完全沉淀以后,开始生成Ag2CrO4砖红色沉淀,则滴入最后一滴硝酸银溶液时,溶液中出现砖红色深沉;
Cr2O72-+H2O;滴定过程中首先析出沉淀为AgCl,当氯离子完全沉淀以后,开始生成Ag2CrO4砖红色沉淀,则滴入最后一滴硝酸银溶液时,溶液中出现砖红色深沉;故答案为:2CrO42-+2H+
 Cr2O72-+H2O;加入最后一滴AgNO3溶液出现砖红色沉淀;
Cr2O72-+H2O;加入最后一滴AgNO3溶液出现砖红色沉淀;(1)由于存在2 CrO42-+2 H+?Cr2O72-+H2O,若小于6.5,氢离子浓度较大,则该平衡向右移动,c(CrO42-)减小,根据Ag2CrO4的KSP可知c(CrO42-)减小,则需要的c(Ag+)增大,则测定结果增大;
故答案为:由于存在2 CrO42-+2 H+?Cr2O72-+H2O,若小于6.5则该平衡向右移动c(CrO42-)减小,根据Ag2CrO4的KSP可知c(CrO42-)减小,则需要的c(Ag+)增大,则测定结果增大;
(2)洗涤酸式滴定管的操作是:用水洗净酸式滴定管后,再用待装溶液洗,所以其操作为:用水洗净酸式滴定管后,从滴定管上口加入3~5mLAgNO3溶液,倾斜着转动滴定管,使液体润湿全部滴定管内壁,然后,一手控制活塞,将液体从滴定管下部放入预置的烧杯中,重复该操作1~2次即可;
故答案为:倾斜着转动滴定管,使液体润湿全部滴定管内壁,然后,一手控制活塞,将液体从滴定管下部放入预置的烧杯中,重复该操作1~2次即可;
点评:本题考查了沉淀滴定的原理和应用,题目难度较大,注意把握滴定原理以及实验的误差分析,为该题的易错点.

练习册系列答案
相关题目
 运用化学反应原理研究以下问题:
运用化学反应原理研究以下问题: 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡