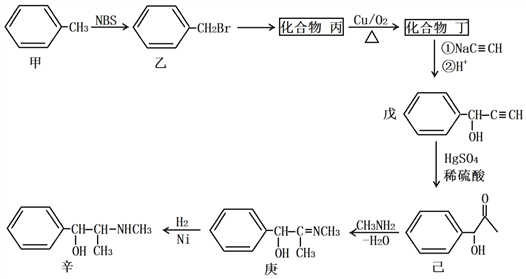
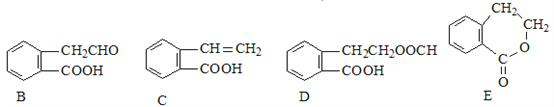
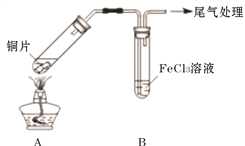
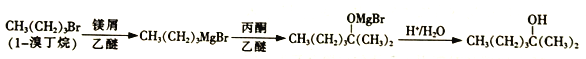题目内容
【题目】海水的综合利用可以制备金属钠和镁等,其流程如图所示。
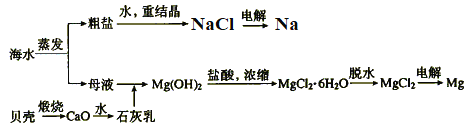
下列说法正确的是
A. 电解NaCl溶液可得到金属钠
B. 上述过程中发生了分解、化合、置换、复分解反应
C. 上述流程中生成Mg(OH)2沉淀的离子方程式为Mg2++2OH-=Mg(OH)2↓
D. 不用电解MgO来制取镁是因为MgO的熔点比MgCl2的高,能耗大
【答案】D
【解析】
A、电解熔融的氯化钠得到金属钠和氯气,电解氯化钠溶液得到氢氧化钠、氢气和氯气,A错误;
B、碳酸钙高温分解是分解反应,氧化钙溶于水生成氢氧化钙是化合反应,氢氧化镁和盐酸反应生成氯化镁和水是复分解反应,电解熔融的氯化钠和氯化镁均是分解反应,过程中没有置换反应,B错误;
C、加入氢氧化钙石灰乳生成Mg(OH)2沉淀,反应的离子方程式为Mg2++Ca(OH)2=Ca2++Mg(OH)2,C错误;
D、氧化镁熔点高消耗能源高,不经济,电解熔融的氯化镁制备,D正确;
答案选D。

练习册系列答案
相关题目