题目内容
【题目】Fe3+具有较强的氧化性,能氧化SO2 。为验证该反应,用1 mol· L-1 FeCl3溶液与SO2进行实验。
(1)Fe3+氧化SO2的反应表示为 M。向黄色FeCl3溶液中通入SO2后,预期的实验现象是__________
(2)用如下图所示装置进行实验。
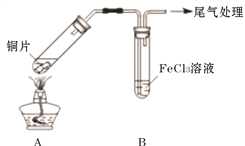
①将A装置加热,反应的化学方程式是____________
②A中产生的气体通入B中后,溶液变为红色。为证明B中Fe3+氧化了SO2,进行如下两个实验方案的实验:
I 取B中红色溶液,加入铁氰化钾溶液,有蓝色沉淀生成,Fe3+与SO2发生氧化还原反应的离子方程式是____________。
II取B中红色溶液,加入用盐酸酸化的BaCl2溶液,有白色沉淀,证明B中Fe3+氧化了SO2。比较I和II实验方案,哪个方案更好,理由是___________。
(3)已知:B中溶液变红的反应:Fe3++6SO2 ![]() Fe(SO2)63+(红色 )K=1 表示为N证明该反应是可逆反应的实验操作是___________。
Fe(SO2)63+(红色 )K=1 表示为N证明该反应是可逆反应的实验操作是___________。
(4)向1 mol· L-1 FeCl3溶液通入足量SO2,溶液很快变为红色;停止通入SO2,静置;15分钟后溶液逐渐变为黄色;60分钟后变为浅绿色。说明B中既发生反应M,也发生了反应N。结合反应速率和平衡移动原理解释溶液很快变红,最终变浅绿的原因____________。
【答案】 黄色溶液逐渐转化为浅绿色 ![]() 2Fe3+ + SO2 +2 H2O = 2Fe2+ + SO42- + 4H+ 采用铁氰化钾检验二价铁更好,如果是检验硫酸根的话,存在空气中氧气氧化溶液中+4价硫的干扰 取红色溶液,加入过量的NaOH溶液,充分混合,静置,上层清液为无色,证明反应N是可逆反应 反应M和反应N相比,反应N的反应速率更快,所以先观察到红色,反应M的反应速率慢,但是限度更大,在反应N达平衡后,反应M建立平衡过程中,不断消耗Fe3+ 和 SO2是使反应N平衡左移,最终溶液呈现浅绿色
2Fe3+ + SO2 +2 H2O = 2Fe2+ + SO42- + 4H+ 采用铁氰化钾检验二价铁更好,如果是检验硫酸根的话,存在空气中氧气氧化溶液中+4价硫的干扰 取红色溶液,加入过量的NaOH溶液,充分混合,静置,上层清液为无色,证明反应N是可逆反应 反应M和反应N相比,反应N的反应速率更快,所以先观察到红色,反应M的反应速率慢,但是限度更大,在反应N达平衡后,反应M建立平衡过程中,不断消耗Fe3+ 和 SO2是使反应N平衡左移,最终溶液呈现浅绿色
【解析】(1) FeCl3溶液呈黄色,被SO2还原后生成Fe2+,所以溶液的颜色由黄色逐渐变浅绿色;
(2)①根据实验的要求,在A装置中产生的SO2通入B中与FeCl3溶液反应,所以A中试管内是浓硫酸与铜的反应,化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;②取B中红色溶液,加入铁氰化钾溶液,有蓝色沉淀生成,证明溶液中含有Fe2+,所以Fe3+与SO2发生氧化还原反应的离子方程式是2Fe3+ + SO2 +2 H2O = 2Fe2+ + SO42- + 4H+;由于SO2溶于水生成的亚硫酸很容易被空气氧化为硫酸,在加入BaCl2溶液后,即可生成白色沉淀,因此有白色沉淀生成不能确定是Fe3+氧化了SO2,所以采用I方案更好,因为铁氰化钾检验二价铁,可排除空气中氧气氧化溶液中+4价硫生成SO42-的干扰;
CuSO4+SO2↑+2H2O;②取B中红色溶液,加入铁氰化钾溶液,有蓝色沉淀生成,证明溶液中含有Fe2+,所以Fe3+与SO2发生氧化还原反应的离子方程式是2Fe3+ + SO2 +2 H2O = 2Fe2+ + SO42- + 4H+;由于SO2溶于水生成的亚硫酸很容易被空气氧化为硫酸,在加入BaCl2溶液后,即可生成白色沉淀,因此有白色沉淀生成不能确定是Fe3+氧化了SO2,所以采用I方案更好,因为铁氰化钾检验二价铁,可排除空气中氧气氧化溶液中+4价硫生成SO42-的干扰;
(3)由于Fe3+和SO2都能与NaOH反应,所以向红色溶液中加入过量的NaOH溶液,充分混合,有红褐色沉淀生成,静置后,溶液变为无色,即说明反应N向逆反应进行了,说明该反应为可逆反应;
(4)根据题目的叙述可推出,反应N的速率比反应M更快,所以先观察到溶液变红色;但停止通入SO2,静置15分钟后溶液逐渐变为黄色,说明反应N向左进行了,即反应N是可逆的,更重要的是说明反应M进行的程度很大,Fe3+不断氧化SO2,使Fe3+和SO2的浓度减小,导致反应N的平衡不断向左移动,最终Fe3+被SO2还原为Fe2+使溶液呈浅绿色。