题目内容
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g),若经 2 s(秒)后测得C 的浓度为 0.6 mol·L-1 ,则:① 用物质 A 表示的反应的平均速率 ② 2 s 时物质 B 的浓度为 。
2C(g),若经 2 s(秒)后测得C 的浓度为 0.6 mol·L-1 ,则:① 用物质 A 表示的反应的平均速率 ② 2 s 时物质 B 的浓度为 。
 2C(g),若经 2 s(秒)后测得C 的浓度为 0.6 mol·L-1 ,则:① 用物质 A 表示的反应的平均速率 ② 2 s 时物质 B 的浓度为 。
2C(g),若经 2 s(秒)后测得C 的浓度为 0.6 mol·L-1 ,则:① 用物质 A 表示的反应的平均速率 ② 2 s 时物质 B 的浓度为 。①0.3mol·L-1·S-1 ②0.7mol·L-1
试题分析: 2A(g)+B(g)
 2C(g)
2C(g)起始浓度(mol/L) 2 1 0
转化浓度(mol/L) 0.6 0.3 0.6
2s时浓度(mol/L) 1.4 0.7 0.6
所以用物质 A 表示的反应的平均速率=0.6mol/L÷2s=0.3mol·L-1·S-1
2 s 时物质 B 的浓度为0.7mol/L
点评:该题时基础性计算题的考查,难度不大。该类试题需要注意的是在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 PCl3(g)+C12(g)
PCl3(g)+C12(g)  H=124kJ·mol-1。反应过程中测定的部分数据见下表:
H=124kJ·mol-1。反应过程中测定的部分数据见下表: CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)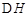 =-49.0kJ·mol
=-49.0kJ·mol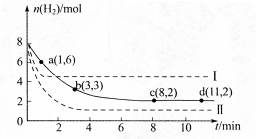
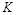 ,曲线Ⅰ对应条件下平衡常数为
,曲线Ⅰ对应条件下平衡常数为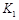 ,曲线Ⅱ对应条件下平衡常数为
,曲线Ⅱ对应条件下平衡常数为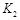 ,则
,则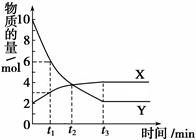

 3C中,生成物B的浓度在10s内从1.5 mol/L变成2.0mol/L,则这10s内用生成物C的浓度变化表示的化学反应速率为
3C中,生成物B的浓度在10s内从1.5 mol/L变成2.0mol/L,则这10s内用生成物C的浓度变化表示的化学反应速率为