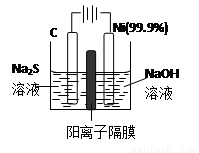
题目内容
Na2S溶液中存在多种微粒,下列各微粒间的关系正确的是 ( )
| A.c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) |
| B.c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
| C.c(Na+)=c(HS-)+2c(H2S)+2c(S2-) |
| D.c(OH-)=c(H+)+c(HS-)+2c(H2S) |
AD
解析正确答案:AD
B、不正确,电荷守恒,应为c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)
C、不正确,物料守恒:c(Na+)=2c(HS-)+2c(H2S)+2c(S2-)
D、正确,是质子守恒。

 阅读快车系列答案
阅读快车系列答案硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在。
(1)已知:①Na2SO4(s)=Na2S(s)+2O2(g) ; ΔH1= +1011.0 kJ · mol-1
②C(s)+O2(g)=CO2(g) ; ΔH2=-393.5 kJ · mol-1
③2C(s)+O2(g)=2CO(g) ; ΔH3=-221.0 kJ · mol-1
则反应④Na2SO4(s)+4C(s)=Na2S(s)+4CO(g);ΔH4= kJ · mol-1,该反应能自发进行的原因是 ;工业上制备Na2S不用反应①,而用反应④的理由是 。
(2)已知不同温度下2SO2+O2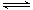 2SO3的平衡常数见下表。
2SO3的平衡常数见下表。
|
温度(℃) |
527 |
758 |
927 |
|
平衡常数 |
784 |
1.0 |
0.04 |
1233℃时,CaSO4热解所得气体的主要成分是SO2和O2,而不是SO3的原因是 。
(3)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是 。
②将上述反应获得的SO2通入含PtCl42-的酸性溶液,可还原出Pt,则反应的离子方程式是 。
③由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图,则正极的电极反应式为 。

 硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:
硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题: