题目内容
如下图所示,室温下向盛有3.0 mL NO的试管中缓缓通入1.5 mL O2(所有气体体积均在标准状下测定)。
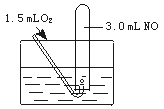
试回答下列问题:
(1)写出观察到的现象(可不写满,也可补充):
①_______________________________;
②_______________________________;
③_______________________________。
(2)最终试管中剩余的气体是_________,体积为_________。

试回答下列问题:
(1)写出观察到的现象(可不写满,也可补充):
①_______________________________;
②_______________________________;
③_______________________________。
(2)最终试管中剩余的气体是_________,体积为_________。
(1)①通入O2,试管内气体变为红棕色②试管内液面升高③最后试管内剩余一种无色气体
(2)NO 1.0 mL
(2)NO 1.0 mL
(1)通入的O2与NO发生反应生成NO2:
①2NO+O2=2NO2
所以看到有红棕色气体生成.生成的NO2溶于水:
②3NO2+H2O =2HNO3+NO
①②两反应的总方程式为:
③4NO+3O2+2H2O =4HNO3
气体被消耗,所以又会看到试管内液面上升.V(NO)∶V(O2)≠4∶3,故最后有气体剩余,不论剩余NO还是O2,都为无色气体,这是看到的第三个现象。
(2)设1.5 mL O2全部参加反应,由(1)中③知:
V反应(NO)=V反应(O2)×4/3=1.5 mL×4/3=2.0 mL
而NO的总体积是3.0 mL,故剩余NO气体1.0 mL。
①2NO+O2=2NO2
所以看到有红棕色气体生成.生成的NO2溶于水:
②3NO2+H2O =2HNO3+NO
①②两反应的总方程式为:
③4NO+3O2+2H2O =4HNO3
气体被消耗,所以又会看到试管内液面上升.V(NO)∶V(O2)≠4∶3,故最后有气体剩余,不论剩余NO还是O2,都为无色气体,这是看到的第三个现象。
(2)设1.5 mL O2全部参加反应,由(1)中③知:
V反应(NO)=V反应(O2)×4/3=1.5 mL×4/3=2.0 mL
而NO的总体积是3.0 mL,故剩余NO气体1.0 mL。

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
 。请回答:
。请回答: 成 功
成 功 成 功
成 功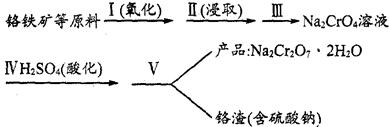
 8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
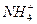 、
、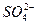 、Fe2+和结晶水,设计了下列操作步骤:①取少量该化合物加热,发现试管口处有液体,该液体能使无水硫酸铜变蓝;②另取少量该化合物溶于水中,滴加少量的氯水,再加入KSCN溶液,有血红色出现;③取少量溶液于试管中,加入盐酸,没有现象,再加入BaCl2溶液,有白色沉淀生成;④取少量溶液于试管中,加入浓的NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时也有白色沉淀产生,该沉淀很快变成灰绿色沉淀。
、Fe2+和结晶水,设计了下列操作步骤:①取少量该化合物加热,发现试管口处有液体,该液体能使无水硫酸铜变蓝;②另取少量该化合物溶于水中,滴加少量的氯水,再加入KSCN溶液,有血红色出现;③取少量溶液于试管中,加入盐酸,没有现象,再加入BaCl2溶液,有白色沉淀生成;④取少量溶液于试管中,加入浓的NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时也有白色沉淀产生,该沉淀很快变成灰绿色沉淀。