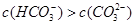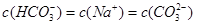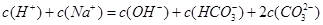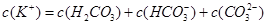题目内容
下列各选项所述的两个量中,前者一定小于后者的是( )
| A.纯水在25 ℃和100 ℃时的pH |
| B.CH3COONa溶液中Na+和CH3COO-的浓度 |
| C.相同温度下,0.1 mol/LCH3COOH溶液和0.3 mol/LCH3COOH溶液的电离平衡常数 |
| D.用0.1 mol/LNaOH溶液分别中和pH、体积均相同的盐酸和醋酸,所消耗NaOH溶液的体积 |
D
试题分析:A.Kw是水的离子积常数,常温下,kw=c(H+)×c(OH-)═1×10-14,水电离出的c(H+)=c(OH-)═1×10-7mol/L,其pH=7水的电离是吸热过程,温度升高促进电离,100℃时水中氢离子和氢氧根离子浓度大于25℃时水中氢离子和氢氧根离子浓度,100℃时kw=1×10-12,其pH=6,前者大于后者,故A错误;B.CH3COONa溶液中CH3COO-离子水解,溶液呈碱性,故溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c( H+),前者大于后者,故B错误;C.相同温度下CH3COOH溶液的电离平衡常数是一个定值,和浓度无关。前者等于后者。D.pH和体积均相同,说明n(H+)相等,但是醋酸是弱酸,不完全电离,所以醋酸的浓度大于盐酸浓度,所以消耗NaOH的物质的量盐酸<醋酸,前者小于后者,故D正确;

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
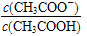 变大
变大 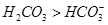 ,碱性
,碱性