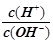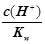题目内容
已知MOH为一元弱碱,25℃时,电离常数Kb= 1×10- 6mol·L-1,
(1)25℃时,将0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,此时混合溶液中由水电离出的c(H+)=Amol·L-1,若0.2 mol/L HCl溶液中由水电离出的c(H+)=Bmol·L-1,则:
①比较A B。(填“>”、“<”或“=”)
②根据电荷守恒,计算混合溶液中c(Cl-)-c(M+)=______ mol·L-1。 (精确计算,填具体数字)
(2)25℃时,0.01 mol·L-1MOH溶液的 pH=10,将其与等体积 pH = 4的盐酸溶液混合,则混合溶液的pH 7(填“>”、“<”或“=”),试求此时溶液中M Cl的水解平衡常数Kh= mol/L
(1)25℃时,将0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,此时混合溶液中由水电离出的c(H+)=Amol·L-1,若0.2 mol/L HCl溶液中由水电离出的c(H+)=Bmol·L-1,则:
①比较A B。(填“>”、“<”或“=”)
②根据电荷守恒,计算混合溶液中c(Cl-)-c(M+)=______ mol·L-1。 (精确计算,填具体数字)
(2)25℃时,0.01 mol·L-1MOH溶液的 pH=10,将其与等体积 pH = 4的盐酸溶液混合,则混合溶液的pH 7(填“>”、“<”或“=”),试求此时溶液中M Cl的水解平衡常数Kh= mol/L
(1) ①> ②9.9×10-7 (2)> ;10-8
试题分析:混合溶液的pH=6,而0.2 mol/L 的盐酸中c(H+)要大,对水的电离的抑制程度大,所以A>B
由电荷守恒c(Cl-)-c(M+)= c(H+)-c(OH-),10-6-10-8=9.9×10-7 ;(2)碱过量,所以最后的溶液的呈碱性;M Cl的水解平衡常数Kh= Kw/Kb为10-8

练习册系列答案
相关题目
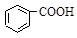 >HSO3->
>HSO3->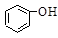 水杨酸(
水杨酸(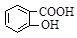 )与亚硫酸钠溶液反应,可能发生反应的离子方程式书写正确的是
)与亚硫酸钠溶液反应,可能发生反应的离子方程式书写正确的是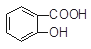 + SO32―→
+ SO32―→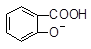 + HSO3―
+ HSO3―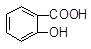 + SO32―→
+ SO32―→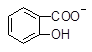 +HSO3―
+HSO3―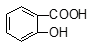 + SO32―→2
+ SO32―→2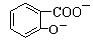 +2HSO3―
+2HSO3― CH3COO-+H+,要使电离平衡右移且c(CH3COO—)增大,应采取的措施是 ( )
CH3COO-+H+,要使电离平衡右移且c(CH3COO—)增大,应采取的措施是 ( )