题目内容
下列有关电解质的电离和水解说法正确的是( )
| A.在25℃时,任何水溶液中Kw=1×10-14。 |
| B.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-) |
| C.在pH=2的盐酸酸化的FeCl3溶液,稀释至10倍,则溶液pH=3 |
| D.0.1mol/L醋酸溶液中加入冰醋酸,平衡正向移动,醋酸的电离程度增大 |
B
试题分析:A.在25℃时,在任何物质的稀的水溶液中存在着Kw=1×10-14。如果浓度较大,就不符合。错误。B.在溶液中H+由H2O和NaHSO4共同电离产生。NaHSO4=Na++H++ SO42-.;H2O
 H++OH-.故c(H+)=c(OH-)+c(SO42-)。正确。C.在pH=2的盐酸酸化的FeCl3溶液,若稀释至10倍,若盐水解的程度不变则溶液pH=3,但稀释使FeCl3的水解程度增大故溶液2<pH<3.错误。D.0.1mol/L醋酸溶液中加入冰醋酸,平衡正向移动,但是增加的醋酸比平衡移动减少的醋酸要多,该醋酸的电离程度反而减小。错误。
H++OH-.故c(H+)=c(OH-)+c(SO42-)。正确。C.在pH=2的盐酸酸化的FeCl3溶液,若稀释至10倍,若盐水解的程度不变则溶液pH=3,但稀释使FeCl3的水解程度增大故溶液2<pH<3.错误。D.0.1mol/L醋酸溶液中加入冰醋酸,平衡正向移动,但是增加的醋酸比平衡移动减少的醋酸要多,该醋酸的电离程度反而减小。错误。
练习册系列答案
相关题目
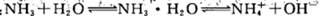 改变下列条件,能使电离程度增大的是
改变下列条件,能使电离程度增大的是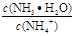 的值都变小
的值都变小 >HSO3->
>HSO3-> 水杨酸(
水杨酸(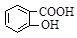 )与亚硫酸钠溶液反应,可能发生反应的离子方程式书写正确的是
)与亚硫酸钠溶液反应,可能发生反应的离子方程式书写正确的是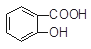 + SO32―→
+ SO32―→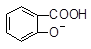 + HSO3―
+ HSO3―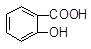 + SO32―→
+ SO32―→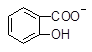 +HSO3―
+HSO3―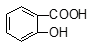 + SO32―→2
+ SO32―→2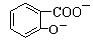 +2HSO3―
+2HSO3―