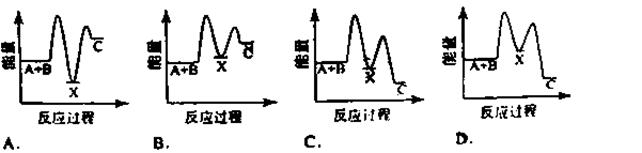
题目内容
已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)=2HCl(g) ΔH=-Q1 kJ/mol
H2(g)+Br2(g)=2HBr(g) ΔH=-Q2 kJ/mol
有关上述反应的叙述正确的是
| A.Q1<Q2 |
| B.生成物总能量均高于反应物总能量 |
| C.生成1molHCl气体时放出Q1热量 |
| D.1molHBr(g)具有的能量大于1molHBr(l)具有的能量 |
D
解析试题分析:A、因为Cl2比Br2活泼,Cl-Cl键能较大,放出的热量更多,应为Q1>Q2,因此A错误;B、两个反应都是放热反应,生成物的总能量低于反应物的总能量,故B错误;C、由热化学方程式可知,生成2mol氯化氢放出的热量才是Q1,故C错误;D、物质在气态时具有的能量一般高于液态和固态时,则1molHBr(g)具有的能量高于1molHBr(l)具有的能量,故D正确,答案选D。
考点:考查反应热的有关判断

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)=S(正交,s) ΔH3
下列说法正确的是( )
| A.ΔH3=+0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s)=S(正交,s) ΔH3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s)=S(正交,s) ΔH3>0,单斜硫比正交硫稳定 |
已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量,②1 mol I2蒸气中化学键断裂时需要吸收151 kJ的能量,③由H原子和I原子形成1 mol HI气态分子时释放299 kJ的能量。下列热化学方程式正确的是
| A.2HI(g) =H2(g)+I2(g)?H=+11 kJ/mol |
| B.H2(g)+I2(g) =2HI(g)?H=-22 kJ/mol |
| C.H2(g)+I2(g) =2HI(g)?H=+288 kJ/mol |
| D.H2(g)+ I2(g) =2HI(g)?H=-144 kJ/mol |
人类将在几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能转换形态),届时人们将适应“低碳经济”和“低碳生活”。下列说法不正确的是
| A.煤、石油和天然气都属于碳素燃料 |
| B.发展太阳能经济有助于减缓温室效应 |
| C.太阳能电池可将太阳能直接转化为电能 |
| D.目前研究菠菜蛋白质“发电”不属于太阳能文明 |
下列说法中正确的是
| A.物质发生化学反应时不一定都伴随着能量变化 |
| B.伴有能量变化的变化都是化学变化 |
| C.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
| D.反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
H2(g)+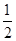 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
由此可知,在等温下蒸发36 g液态水需吸收的热量( )
| A.483.6 kJ | B.88 kJ | C.285.8 kJ | D.44 kJ |
分析能量变化示意图,下列选项正确的是
| A.S(s,单斜)+O2(g)=SO2(g)△H ="+297.16" kJ?mol-1 |
| B.S(s,单斜)+O2(g)=SO2(g)△H ="-296.83" kJ?mol-1 |
| C.S(s,正交)+O2(g)=SO2(g)△H ="-296.83" kJ?mol-1 |
| D.单斜硫比正交硫更稳定 |
已知2H2(g)+O2(g) =2H2O(l)△H=—571.6kJ·mol—1,2H2(g)+O2(g)=2H2O(g)△H=—483.6kJ·mol—1。下列说法正确的是
| A.1molH2O(l)变成1mo1H2O(g),吸收88 kJ能量 |
| B.1 molH2O(g)分解成H2(g)和O2 (g),吸收241.8kJ能量 |
| C.2 molH2(g)和1molO2(g)的总能量小于2molH2O(l)的能量 |
| D.可以寻找特殊催化剂使H2O分解,同时放出能量 |