题目内容
已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量,②1 mol I2蒸气中化学键断裂时需要吸收151 kJ的能量,③由H原子和I原子形成1 mol HI气态分子时释放299 kJ的能量。下列热化学方程式正确的是
| A.2HI(g) =H2(g)+I2(g)?H=+11 kJ/mol |
| B.H2(g)+I2(g) =2HI(g)?H=-22 kJ/mol |
| C.H2(g)+I2(g) =2HI(g)?H=+288 kJ/mol |
| D.H2(g)+ I2(g) =2HI(g)?H=-144 kJ/mol |
A
解析试题分析:A、反应热=生成物的键能减反应物的键能=436kJ·mol-1+151kJ·mol-1-2×299 kJ·mol-1=+11kJ?mol-1,故1mol氢气与1mol氯气反应时吸收热量为11KJ,△H=+11kJ·mol-1,A正确;B、由A可知,B中?H=-11 kJ/mol,B、C、D均错误;选A。
考点:有关键能和反应热的计算

练习册系列答案
相关题目
下列变化过程,属于放热反应的是 ( )
①生石灰与水反应;②NH4Cl晶体与Ba(OH)2·8H2O混合搅拌;③醋酸电离;④固体氢氧化钠溶于水;⑤H2在Cl2中燃烧;⑥浓H2SO4稀释;⑦酸碱中和反应
| A.①②⑤ | B.①⑤⑦ | C.①④⑤⑥⑦ | D.③⑥⑦ |
已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量为b kJ,则乙炔燃烧的热化学方程式正确的是( )
| A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH=-4b kJ·mol-1 |
| B.C2H2(g)+5/2 O2(g)=2CO2(g)+H2O(l)ΔH="2b" kJ·mol-1 |
| C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH=-2b kJ·mol-1 |
| D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH="b" kJ·mol-1 |
如下图所示,△H1=-393.5 kJ?mol-1,△H2=-395.4 kJ?mol-1,下列说法或表示式正确的是( )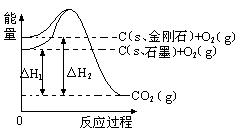
| A.C(s、石墨)=C(s、金刚石) △H="+1.9" kJ?mol-1 |
| B.石墨和金刚石的转化是物理变化 |
| C.金刚石的稳定性强于石墨 |
| D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
下列关于能源和作为能源的物质叙述错误的是
| A.化石能源物质内部蕴涵着大量的能量 |
| B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 |
| C.物质的化学能可以在不同的条件下转化为热能、电能被人类利用 |
| D.吸热反应没有利用价值 |
已知CO(g)+H2O(g) H2(g)+CO2(g)△H<0,若其他条件不变,以下说法中正确的是
H2(g)+CO2(g)△H<0,若其他条件不变,以下说法中正确的是
| A.加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B.升高温度,反应速率加快,反应放出的热量不变 |
| C.改变压强,平衡不发生移动,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |
已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)=2HCl(g) ΔH=-Q1 kJ/mol
H2(g)+Br2(g)=2HBr(g) ΔH=-Q2 kJ/mol
有关上述反应的叙述正确的是
| A.Q1<Q2 |
| B.生成物总能量均高于反应物总能量 |
| C.生成1molHCl气体时放出Q1热量 |
| D.1molHBr(g)具有的能量大于1molHBr(l)具有的能量 |
 CO2(g); ΔH=-395.5 kJ·mol-1
CO2(g); ΔH=-395.5 kJ·mol-1