题目内容
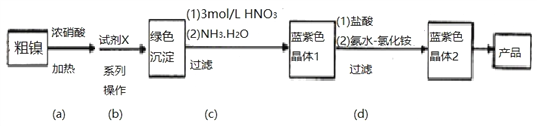
【题目】某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下。
已知:①部分离子生成氢氧化物沉淀的pH如下表所示。
②Ni( OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
(1)步骤(a)中Ni和浓硝酸反应的化学方程式为__________________________________。
(2)步骤(b)首先加入试剂X调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是____________________________________________。
②试剂X可以是___________________(填标号)。
A. H2SO4 B.Ni(OH)2 C.NaOH D.Fe2O3 E.NiO
(3)NH3含量的测定
i.用电子天平称量mg产品于锥形瓶中,用25 mL水溶解后加入3.00 mL6 mol/L盐酸,以甲基橙作指示剂,滴定至终点消耗0.5000 mol/L NaOH标准溶液V1mL;
ii.空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
①NH3的质量分数为___________________________。
②在上述方案的基础上,下列措施能进一步提高测定准确度的有___________(填标号)。
A.适当提高称量产品的质量 B.用H2SO4溶液替代盐酸
C.用酚酞替代甲基橙 D.进行平行试验
(4)为测定Cl的含量,请补充完整下述实验方案。
称量mg产品于锥形瓶中,用25 mL水溶解,___________________________________,滴入2—3滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作2-3次。
【答案】 Ni+4HNO3(浓)![]() Ni(NO3)2+2NO2↑+2H2O pH=6时,Fe3+、Cr3+完全沉淀,而Ni2+未开始沉淀 C 0.5(V2-V1) ×10-3×17/m ×100% AD 加入稀硝酸至溶液呈弱酸性
Ni(NO3)2+2NO2↑+2H2O pH=6时,Fe3+、Cr3+完全沉淀,而Ni2+未开始沉淀 C 0.5(V2-V1) ×10-3×17/m ×100% AD 加入稀硝酸至溶液呈弱酸性
【解析】试题分析:本题以粗镍为原料制备Ni(NH3)6Cl2的流程为载体,考查流程的分析,化学方程式的书写,物质的分离提纯,滴定实验的应用。
(1)步骤(a)粗镍中加入浓硝酸,由于浓硝酸具有强氧化性,将Ni、Fe、Cr氧化成Ni(NO3)2、Fe(NO3)3、Cr(NO3)3,自身被还原成NO2,Ni与浓硝酸反应的化学方程式为:Ni+4HNO3(浓)![]() Ni(NO3)2+2NO2↑+2H2O。
Ni(NO3)2+2NO2↑+2H2O。
(2)①根据表中提供的各离子开始沉淀和完全沉淀的pH,首先加入X试剂调节溶液的pH约为6,可使Fe3+、Cr3+完全转化为沉淀,Ni2+不形成沉淀,将溶液中的Fe3+、Cr3+除去。
②试剂X一方面调节溶液的pH使Fe3+、Cr3+转化为沉淀而除去,另一方面可与Ni(NO3)2反应形成绿色Ni(OH)2沉淀,试剂X可以为NaOH;Ni(OH)2、NiO也可调节pH,但不能与Ni(NO3)2作用形成Ni(OH)2沉淀;答案选C。
(3)①步骤i,产品中NH3先与HCl反应生成NH4Cl,用NaOH溶液滴定剩余的HCl;步骤ii没有加产品,NaOH滴定HCl;则实验中与产品反应的n(HCl)=0.5000mol/L(V2-V1)/1000L=0.5(V2-V1)/1000mol,n(NH3)=n(HCl)=0.5(V2-V1)/1000mol,m(NH3)=0.5(V2-V1)/1000mol![]() 17g/mol=0.5(V2-V1)
17g/mol=0.5(V2-V1)![]() 10-3
10-3![]() 17g,NH3的质量分数为0.5(V2-V1)
17g,NH3的质量分数为0.5(V2-V1)![]() 10-3
10-3![]() 17/m
17/m![]() 100%。
100%。
② A项,适当提高称量产品的质量,可减小实验误差,提高测定的准确度;B项,H2SO4溶液和盐酸都属于强酸,用硫酸溶液替代盐酸不能提高测定的准确度;C项,若用酚酞代替甲基橙,由于酚酞的变色范围在8.2~10,步骤i中消耗的NaOH偏多,使测得的NH3的质量分数偏低,误差大;D项,进行平行试验,减少偶然误差,能提高测定的准确度;答案选AD。
(4)根据实验目的和实验内容,测定Cl的含量采用的是沉淀滴定法。由于Ni(NH3)6Cl2为可溶于水的蓝紫色晶体,水溶液显碱性,OH-会消耗AgNO3,所以在滴定之前要向样品溶液中加入稀硝酸至溶液呈弱酸性。

【题目】用下列实验装置完成对应的实验,不能达到实验目的的有_____个
1 | 2 | 3 | 4 |
|
|
|
|
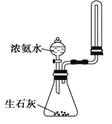
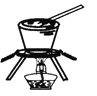
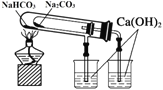
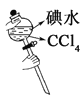
制取并收集少量氨气 | 从饱和食盐水中提取NaCl晶体 | 验证NaHCO3和Na2CO3的热稳定性 | 采用CCl4萃取I2 |
A. 1个 B. 2个 C. 3个 D. 4个