题目内容
【题目】利用下列装置,可完成很多电化学实验。下列有关叙述,正确的是( )
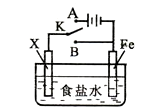
A.若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法
B.若X为铜棒,开关K置于A处,装置中发生的总反应为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
C.若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红
D.若X为碳棒,开关K置于B处,在铁棒附近滴入硫氰化钾溶液可看到溶液变血红色
【答案】C
【解析】
试题分析:A.X为锌棒,开关K置于A处,形成电解池,Fe为阴极,可减缓铁的腐蚀,这种方法称为外加电源的阴极保护法,故A错误;B.若X为铜棒,开关K置于A处,为电解池反应,铁为阴极,阳极上铜被氧化生成铜离子,阳极上不生成氯气,故B错误;C.若X为碳棒,开关K置于B处,为铁的吸氧腐蚀,正极发生还原反应,氧气得电子生成氢氧根离子,滴入酚酞溶液变红,故C正确.D.若X为碳棒,开关K置于B处,为铁的吸氧腐蚀,铁被氧化生成亚铁离子,滴加滴入硫氰化钾溶液不变色,故D错误;故选C。

【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于周期表的 区;溴的价电子排布式为 .
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是 .
(3)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是
氟 | 氯 | 溴 | 碘 | 铍 | |
第一电离能 | 1681 | 1251 | 1140 | 1008 | 900 |
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I﹣+I2=I3﹣.I3﹣离子的中心原子周围σ键电子对对数为 ,孤电子对对数为 与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列 式发生.
A.CsICl2═CsCl+ICl B.CsICl2═CsI+Cl2
(5)已知ClO2﹣为V形,中心氯原子周围有四对价层电子.ClO2﹣中心氯原子的杂化轨道类型为 ,写出一个ClO2﹣的等电子体 .
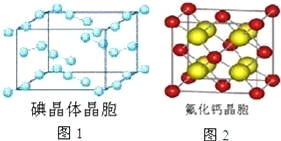
(6)图1为碘晶体晶胞结构.有关说法中正确的是 .
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以配位数4交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为 .
【题目】如图所示装置中,可观察到电流表指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )
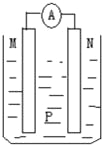
选 项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 铁 | 稀盐酸 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D