题目内容
【题目】某学习小组为探究镁及其化合物的性质,查阅资料知:
ⅰ | Mg3N2遇水发生水解反应 |
ⅱ | 2NO2+2NaOH=NaNO2+NaNO3+H2O NO2+NO+2NaOH=2NaNO2+H2O |
ⅲ | 常溫下,NH3·H2O、CH3COOH的电离常数均为1.8×10-5 |
I.探究镁的性质。
为探究镁与二氧化氮反应的产物,设计如图所示实验装置。
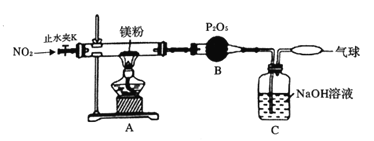
(1)简述检查该装置气密性的方法________;B装置的作用是___________.
(2)实验时,当A装置中充满红棕色气体时点燃酒精灯,这样操作的目的是_______。
(3)确定有N2生成的实验现象是__________。
(4)实验完毕,为确认产物中有Mg3N2,取少量A中固体于试管中,滴加蒸馏水,_______,则产物中有氮化镁。
(5)经测定,Mg与NO2反应生成MgO、Mg3N2和N2,其中Mg3N2和N2的物质的量相等。
请写出A中发生反应的化学方程式:___________________
Ⅱ.探究Mg(OH)2在氯化铵溶液中溶解的原因。
供选试剂有:氢氧化镁、蒸馏水、硝酸铵溶液、盐酸、醋酸铵溶液。
取少量氢氧化镁粉末于试管中,向其中加人足量饱和氯化氨溶液,振荡,白色粉末全部溶解。为了探究其原因,他们依据Mg(OH)2(s)==Mg2+(aq)+2OH-(aq)提出两种假设。
假设1:氯化铵溶液呈酸性,H++OH-=H2O,促进Mg(OH)2溶解;
假设2:NH4++OH-=NH3·H2O,促进Mg(OH)2溶解。
(6)请你帮他们设计实验验证哪一种假设正确:____________.
【答案】 关闭止水夹K,用酒精灯微热硬质玻璃管,气球膨胀,冷却后,气球恢复原状,则装置气密性良好 吸收C中挥发出来的水蒸气 排尽装置内空气,避免O2、CO2、N2等与镁反应 C中产生气泡,气球的体积变得更大 若有刺激性气味的气体逸出,该气体能使湿润红色石蕊试纸变蓝色 11Mg+4NO2![]() 8MgO+Mg3N2+N2;(写成4Mg+2NO2
8MgO+Mg3N2+N2;(写成4Mg+2NO2![]() 4MgO+N2、3Mg+N2
4MgO+N2、3Mg+N2![]() Mg3N2也给分) 取少量氢氧化镁于试管中,加入足量CH3COONH4溶液,若白色固体溶解,则假设2正确;若白色固体不溶解,则假设1正确。
Mg3N2也给分) 取少量氢氧化镁于试管中,加入足量CH3COONH4溶液,若白色固体溶解,则假设2正确;若白色固体不溶解,则假设1正确。
【解析】试题分析:I.(1)根据热胀冷缩原理检验装置气密性;P2O5是干燥剂,Mg3N2遇水发生水解反应,所以需要防止C中挥发出来的水蒸气进入A;(2)镁是活泼金属,能与O2、CO2、N2等反应;(3)NO2、NO能溶于氢氧化钠溶液;氮气不溶于氢氧化钠溶液;(4)Mg3N2遇水发生水解反应生成氢氧化镁和氨气;(5)根据得失电子守恒配平方程式;Ⅱ. CH3COONH4溶液呈中性,若氢氧化镁能溶于CH3COONH4溶液,则证明假设2正确;
解析:I.(1)根据热胀冷缩原理,关闭止水夹K,用酒精灯微热硬质玻璃管,气球膨胀,冷却后,气球恢复原状,则装置气密性良好;B中P2O5是干燥剂,可以吸收C中挥发出来的水蒸气,防止水蒸气进入A;(2)镁是活泼金属,当A装置中充满红棕色气体时点燃酒精灯,可以防止镁与O2、CO2、N2等反应;(3)NO2、NO能溶于氢氧化钠溶液;氮气不溶于氢氧化钠溶液,所以有N2生成的实验现象是C中产生气泡,气球的体积变得更大;(4)Mg3N2遇水发生水解反应生成氢氧化镁和氨气;取少量A中固体于试管中,滴加蒸馏水,若有刺激性气味的气体逸出,该气体能使湿润红色石蕊试纸变蓝色,则证明有Mg3N2生成。(5)Mg与NO2反应生成MgO、Mg3N2和N2,其中Mg3N2和N2的物质的量相等,根据得失电子守恒,反应方程式为11Mg+4NO2![]() 8MgO+Mg3N2+N2;Ⅱ. 取少量氢氧化镁于试管中,加入足量CH3COONH4溶液,若白色固体溶解,则假设2正确;若白色固体不溶解,则假设1正确。
8MgO+Mg3N2+N2;Ⅱ. 取少量氢氧化镁于试管中,加入足量CH3COONH4溶液,若白色固体溶解,则假设2正确;若白色固体不溶解,则假设1正确。

 口算题天天练系列答案
口算题天天练系列答案